Artigo
Extrações de própolis vermelha do nordeste brasileiro em diferentes concentrações alcoólicas, com diferentes solventes e suas atividades contra Staphylococcus aureus.
Cleber Silveira Moraes; Andreas Daugsch; Patrícia Fort; Yong Kun Park *.Universidade Estadual de Campinas-UNICAMP, Faculdade de Engenharia de Alimentos, Caixa Postal 6177, CEP 13081-970, Campinas-SP.
* Professor e coordenador deste trabalho. Fone: 55-19-3521-2157, 55-19-3521-2175, e-mail: ykpark@fea.unicamp.br.
Resumo:
Própolis é uma substância resinosa elaborada por abelhas da espécie Apis mellifera e usada como revestimento da colméia. Para a produção da própolis as abelhas usam a matéria prima coletada de diversas partes da planta como broto, botões florais, exsudatos resinosos e outras partes do tecido vegetal. A própolis é utilizada na medicina popular a 300 anos antes de Cristo principalmente por apresentar propriedades antimicrobiana, antiinflamatória e cicatrizante. Nos últimos anos foi demonstrado que alguns tipos de própolis apresentam atividade antioxidante, hipotensiva, anestésica, anticâncer, anti-HIV e anticariogênica.
As própolis brasileiras são classificadas em 13 grupos conforme sua composição físico-química, que é diretamente relacionada com a planta utilizada pelas abelhas para coleta das resinas e exsudatos. Nesse trabalho foram escolhidas a própolis vermelha do grupo 13 por apresentar alta atividade biológica, além de ser a própolis mais comercializada no nordeste brasileiro.
A própolis do grupo 13 possui coloração avermelhada variando a tonalidade entre vermelho claro e vermelho muito escuro conforme a composição química presente. A própolis do grupo 13 provém de exsudatos do caule de Dalbergia ecastophyllum.
Nesse trabalho foram avaliadas as quantidades de compostos fenólicos e flavonóides nas própolis do grupo 13 e sua atividade contra Staphylococcus aureus em extratos obtidos usando extrato aquoso (0% de etanol), extratos obtidos com diferentes concentrações de etanol (10-100%) e extratos usando os solventes: metanol, etanol, acetato de etila, hexano, clorofórmio e acetona.
1. Introdução
Há uma longa história do uso da própolis, que começou há 300 anos antes de Cristo, onde a própolis era utilizada pelos egípcios para mumificação dos faraós, porém recebeu dos gregos o nome própolis, que significa "pro" "a favor" e "polis" "cidade", pelo fato de que os gregos a utilizavam para cicatrização de feridas (Ayala et al., 1985; Bankova et al., 1983; Dobrowolski et al., 1991; Esser, 1986; Ghisalberti, 1979; Hausen et al., 1987; Park et al., 2004).
Na atualidade a própolis é usada como remédio caseiro e de uso estético, principalmente depois de constatado que a própolis possui várias atividades biológicas como ação antiséptica, antimicótica, bacteriostática, antiinflamatória, antioxidante, sendo utilizada nos tratamentos de queimaduras, dermatites, ulceras, psoríase, herpes e pruridos porque promove a regeneração de tecidos. A própolis é também utilizada contra reumatismo, gengivites, estomatites, apresentando ação anestésica cinco vezes mais eficaz que a cocaína. Foi comprovado que a própolis possui todas essas atividades biológicas devido a possuir na sua constituição compostos fenólicos, principalmente flavonóides (Ayala et al., 1985; Bankova et al., 1983; Burdock, 1998; Dobrowolski et al., 1991; Esser, 1986; Ghisalberti, 1979; Hausen et al., 1987; Park et al., 1998; Park et al., 2004).
As própolis brasileiras são classificadas em 13 grupos conforme sua composição físico-química, que é diretamente relacionada com a planta utilizada pelas abelhas ( Park et al., 2002; Daugsch et al., 2006).
Nesse trabalho foram avaliadas as quantidades de compostos fenólicos e flavonóides nas própolis do grupo 13 e sua atividade contra Staphylococcus aureus em extratos obtidos usando extrato aquoso (0% de etanol), extratos obtidos com diferentes concentrações de etanol (10-100%) e extratos usando os solventes: metanol, etanol, acetato de etila, hexano, clorofórmio e acetona.
2. Materiais e Métodos
2.1 Extração dos compostos químicos da própolis utilizando reagentes diferentes
As amostras brutas de própolis do grupo 13, separadas por respectiva colméia, foram trituradas e pesado 2 gramas. Cada 2 gramas de própolis foi transferido para 1 tubo totalizando 6 tubos. Nos tubos numerados de 1 a 6 foram adicionados respectivamente alíquotas de 25 mL de metanol, etanol, acetato de etila, hexano, clorofórmio e acetona. As amostras foram mantidas a 70º C por 30 minutos, sob agitação constante. Após a incubação, as amostras foram centrifugadas por 10 minutos a 5°C. Os sobrenadantes foram transferidos para tubos de vidro com tampa de rosca para análise.
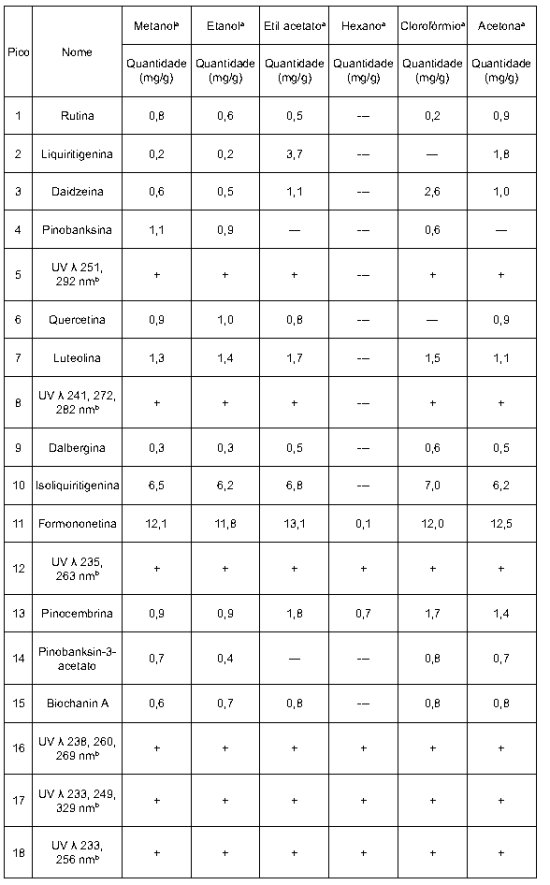
Tabela 1 Flavonóides e outros componentes químicos da própolis dissolvida em diferentes solventes.
a Quantidade dos constituintes em mg/g de própolis. Símbolos: "+" = presente, mas não quantificado.
b Constituintes não identificados representados somente pelo espectro de absorbância máxima UV.
2.2 Extração dos compostos fenólicos de própolis com água destilada e diferentes concentrações de etanol
Amostras de 2 g de própolis em pó do grupo 13 foram transferidos para tubos de ensaio com tampa de rosca contendo 10 mL de água destilada (0% de etanol) e de concentrações crescentes de etanol (10% a 100% de etanol 96°GL). Os tubos de ensaio foram incubados a 70°C durante 30 minutos. As amostras foram centrifugadas como descrito anteriormente e os sobrenadantes foram transferidos para tubos de ensaio com tampa de rosca e armazenados a 5°C para análise posterior das características físico-químicas e atividade antimicrobiana.
2.3 Cromatografia em camada delgada de alta eficiência em fase reversa (CCDAE-FR)
Alíquotas de 3 µL dos EEP foram aplicadas em placas de 0,2 mm de espessura (10x10 cm). Foi utilizado etanol/água (55:45, v/v) como fase móvel e tempo de desenvolvimento da cromatografia de aproximadamente 1 hora e 40 minutos. As placas foram expostas a luz ultravioleta no comprimento de onda de 254 e 366 nm para revelação.
2.4 Cromatografia líquida de alta eficiência em fase reversa (CLAE-FR)
Análises de flavonóides e outros compostos fenólicos de extratos etanólicos de própolis e exudatos resinosos vermelho foram realizadas por CLAE-FR com um cromatógrafo equipado com uma coluna YMC Pack ODS-A (RP-18, coluna de tamanho 4,6 x 250 mm; com partículas de tamanho 5 µm) e detector DAD (SPD-M10A, Shimadzu Co.). A coluna foi eluida usando gradiente linear de água (solvente A) e metanol (solvente B), iniciando com 30% B (0-15 min) e aumentando até 90% B (15-75), parando em 90% B (75-95 min), e diminuindo até 30% B (95-105 min) com um solvente com fluxo de 1 mL/min e detecção com um detector DAD. Os cromatogramas foram realizados a 268 nm. Os padrões autênticos de flavonóides e outros compostos químicos foram obtidos da Extrasynthese Co. França.
2.5 Determinação da atividade antimicrobiana (Antibiograma)
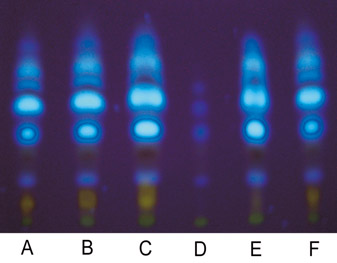
Figura 1 Cromatografia em camada delgada de alta eficiência
(CCDAE-FR) dos extratos de própolis do grupo 13
obtidas com diferentes solventes.
A = Metanol, B = Etanol, C = Acetato de etila,
D = Hexano, E = Clorofórmio, F = Acetona.
A atividade antimicrobiana dos extratos de própolis foi testada usando Staphylococcus aureus. A cultura de S. aureus foi inoculada em toda a superfície da placa de ágar nutriente com swabs estéreis. Em seguida discos de papel impregnados com extratos de própolis, foram colocados na superfície do meio de cultura e as placas foram incubadas por uma noite a 37°C. Para a preparação dos discos de papel, amostras de 10 µL de extratos de própolis foram aplicados nos discos.
3. Resultados e discussão
3.1 Extrações de própolis do grupo 13 utilizando diferentes solventes
A extração de compostos fenólicos de própolis com diferentes solventes e foi testada como descrito no item 2.1.
Foi observado que a própolis grupo 13 teve variação na cor conforme o solvente utilizado.
A Figura 1 ilustra o perfil cromatográfico das amostras de extratos de própolis do grupo 13 obtido com diferentes solventes, em placas de camada delgada RP18F254S. Os extratos de própolis do grupo 13 obtidos com os solventes metanol, etanol, acetato de etila, clorofórmio e acetona apresentaram na cromatografia em camada delgada compostos com maior intensidade de absorção da luz UV do que os extratos obtidos com o solvente hexano.
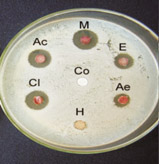
Figura 2 Antibiograma de própolis
do grupo 13 com Staphylococcus
aureus. obtidos com diferentes
solventes.
Co = controle, M = metanol,
E = etanol, Ae = acetato de etila,
H = hexano, Cl = clorofórmio
e Ac = acetona.
Foi observado na Figura 2 que os extratos de própolis do grupo 13 extraídos com metanol, clorofórmio e acetona apresentaram alta atividade antimicrobiana contra Staphylococcus aureus, sendo que os extratos de própolis obtidos com etanol, acetato de etila e hexano apresentaram menor halo de inibição do crescimento de microrganismo.
Foi observado na Figura 3 e Tabela 1 que na própolis do grupo 13, os solventes metanol, etanol, acetato de etila, clorofórmio e acetona extraíram maior quantidade de flavonóides e outros compostos fenólicos.
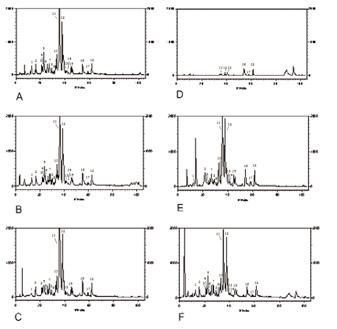
Figura 3 CLAE-FR mostrando a diferença na extração de compostos
fenólicos da própolis do grupo 13 através de diferentes solventes.
A = Metanol, B = Etanol, C = Acetato de etila, D = Hexano,
E = Clorofórmio, F = Acetona.
3.2 Extrações de própolis do grupo 13 utilizando própolis com água destilada e diferentes concentrações de etanol
A extração de compostos fenólicos de própolis com diferentes concentrações etanólicas foi testada como descrito no item 2.2.
A Figura 4 ilustra a coloração dos extratos de própolis do grupo 13 obtidos com água (0% de etanol) e diferentes concentrações de etanol (10-100% de etanol 96°GL).
Foi observado que a própolis do grupo 13 apresentou coloração amarelada quando em concentrações de 0-40%, porém adquiriu cores mais avermelhadas nas concentrações de 50-100%.

Figura 4 Coloração dos extratos etanólicos da própolis do grupo 13
utilizando-se diferentes concentrações de etanol.
A Figura 5 ilustra o perfil de separação dos compostos do extrato aquoso (0% de etanol) e extratos obtidos com diferentes concentrações de etanol (10-100% de etanol 96°GL), em placas de camada delgada RP18F254S. Foi observado que as amostras de própolis extraídas com etanol nas concentrações de 40 a 100% de etanol 96°GL apresentaram, nas placas de cromatografia, maior intensidade de absorção a luz UV indicando maior extração de compostos fenólicos.
Foi observado na Figura 6 que as concentrações etanólicas de própolis do grupo 13 apresentaram concentrações etanólicas inibitórias ideais entre 40-100%, porque inibiram o Staphylococcus aureus com maior intensidade, como pode ser observado pela extensão do halo formado.

Figura 5 Cromatografia de camada delgada dos extratos etanólicos
da própolis do grupo 13 extraídos com água (0% de etanol)
e diferentes concentrações de etanol (0-100%).
4. Conclusões
Concluiu-se que apesar da própolis do grupo 13 possuir grande quantidade de compostos fenólicos, a extração depende intensamente do solvente e da concentração de solvente utilizados.
Destacou-se na própolis do grupo 13 o acetato de etila, o clorofórmio, a acetona e concentrações etanólicas de 50-100%, que extraíram maiores quantidades de compostos fenólicos.
Mostrou-se que a própolis do grupo 13 tem atividade antimicrobiana que varia conforme a quantidade de compostos fenólicos extraídos, verificados na inibição de Staphylococcus aureus em diferentes intensidades, com maior intensidade de inibição para extratos com metanol, clorofórmio e acetona e em concentrações etanólicas entre 40-100%.
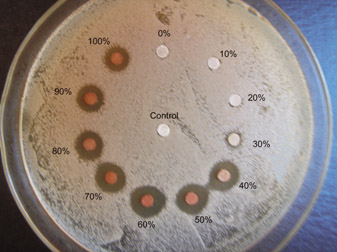
Figura 6 Antibiograma da própolis do grupo 13 com Staphylococcus
aureus obtidos em extrato aquoso e em diferentes concentrações
etanólicas (10-100%).
5. Agradecimentos
Agradecemos o Sr. Edivaldo Pacheco e o Sr. José Alexandre Abreu pela coleta das amostras de própolis e de sua origem botânica Dalbergia ecastophyllum.
6. Referências bibliográficas
1.AYALA, F., LEMBO, G., NAPPA, P. e BALATO, N. Contact dermatitis from propolis. Contact dermatitis, v. 12, p. 181-182, 1985.
2.BANKOVA, V., POPOV, S. e MAREKOV, N.L. A study on flavonoids of propolis. Journal of Natural Products, v. 46, p. 471-474, 1983.
3.BURDOCK, G.A. Review of the biological properties and toxicity of bee propolis (Propolis). Food and Chemical Toxicology, v. 36, p. 347-363, 1998.
4.DAUGSCH, A., MORAES, C.S., FORT, P., PACHECO, E., LIMA, I.B., ABREU, J.A. e PARK, Y.K. Própolis vermelha e sua origem botânica. Mensagem Doce, v. 89, p. 2-15, 2006.
5.DOBROWOLSKI, J.W., VOHORA, S.B., SHARMA, K., SHAH, S.A., NAQVI, S.A.H. e DANDIYA, P.C. Antibacterial, antifungal, antiamoebic, antiinflammatory and antipyretic studies on propolis bee products. Journal of ethnopharmacology, v. 35, p. 77-82, 1991.
6.ESSER, B. Allergy due to propolis. Aktuelle Dermatologie, v. 12, p. 203-205, 1986.
7.GHISALBERTI, E.L. Propolis: a review. Bee World, v. 60, p. 59-84, 1979.
8.HAUSEN, B.M., WOLLENWEBER, E., H., S. e B., P. Propolis allergy I. Origin properties usage and literature review. Contact dermatitis, v. 17, p. 163-170, 1987.
9.PARK, Y.K. e IKEGAKI, M. Preparation of water and ethanolic extracts of propolis and evalution of the preparations. Bioscience Biotechnology Biochemistry, v. 62, p. 2230-2232, 1998.
10.PARK, Y.K., ALENCAR, S.M. e AGUIAR, C.L. Botanical origin and chemical composition of Brazilian propolis. Journal of Agricultural and Food Chemistry, v. 50, n. 9, p. 2502-2506, 2002.
11.PARK, Y.K., PAREDES-GUZMAN, J.F., AGUIAR, C.L., ALENCAR, S.M. e FUJIWARA, F.Y. Chemical constituents in Baccharis dracunculifolia as the main botanical origin of southeastern Brazilian propolis. Journal of Agricultural and Food Chemistry, v. 52, p. 1100-1103, 2004.