Artigo
UM MARCADOR QUÍMICO DE FÁCIL DETECÇÃO PARA A PRÓPOLIS DE ALECRIM-DO-CAMPO (Baccharis dracunculifolia)
Evandro Afonso do Nascimento1, Sérgio Antônio Lemos de Morais1,Dorila Piló-Veloso2, Roberto Chang2 e Débora Costa Reis2
1 Instituto de Química, Universidade Federal de Uberlândia, 38.400-089 Uberlândia - MG
2 Departamento de Química , Universidade Federal de Minas Gerais, 31.270-900 Belo Horizonte - MG
Resumo
O presente trabalho apresenta um marcador químico (MQ) de fácil detecção por cromatografia gasosa para a própolis do alecrim-do-campo (Baccharis dracunculifolia). Trata-se do composto volátil mais abundante no extrato em diclorometano de própolis verdes dessa planta, mas ele aparece também, em diferentes concentrações, em extratos de diclorometano de própolis marrom, preta, vermelha e amarela provenientes de regiões que contêm Baccharis dracunculifolia. O MQ está presente no extrato do broto de alecrim em concentração significativa, mas sua concentração na folha de alecrim é baixa. Própolis de regiões sem alecrim não possuem o MQ. Estudos de espectrometria de massas sugerem que o MQ seja o 3-prenilcinamato de alila recentemente isolado de própolis verdes.
Introdução
A própolis é um produto elaborado pelas abelhas com resinas de árvores, cera, pólen, fragmentos de vegetais e secreção própria1,2. Sua composição química depende, portanto, da flora da região onde é produzida e da época do ano em que é coletada. A própolis do arbusto alecrim-do-campo (Baccharis dracunculifolia), conhecida também como própolis verde, é produzida do broto desta planta3-4 que é endêmica em várias regiões do Brasil. Entretanto, por razões ainda desconhecidas, esta própolis é produzida fundamentalmente no sul, leste, centro e zona da mata de Minas Gerais, leste de São Paulo, norte do Paraná e em regiões serranas do Espírito Santo e Rio de Janeiro.
A própolis de alecrim-do-campo constitui, portanto, um produto tipicamente brasileiro e, devido ao fato de ser altamente eficaz no combate a uma série de microrganismos4,5, é altamente valorizada no mercado internacional, sendo que, somente no Japão, movimenta um mercado da ordem de setecentos milhões de dólares ao ano6.
É interessante observar que a própolis de alecrim-do-campo possui um teor relativamente baixo de flavonóides, constituintes considerados comumente como responsáveis pelas propriedades terapêuticas de própolis7.
Embora seja um produto tipicamente brasileiro e muito usado no Japão, a pesquisa sobre a própolis de alecrim-do-campo é relativamente recente, tendo avançado nos últimos anos, tanto no Brasil8-13 quanto no exterior14-16. Empresários brasileiros do ramo têm contribuído também para organizar e estimular sua pesquisa, sua produção e comercialização6.
A análise química da própolis é muito dificultada, devido ao fato de se tratar de uma mistura de produtos que varia de acordo com a flora de cada região e da época do ano. Ultimamente, esta análise tem se concentrado nos extratos aquoso e etanólico porque são os mais usados nos diversos tipos de aplicações terapêuticas8,14-15 . A técnica mais utilizada é a cromatografia líquida de alta eficiência (CLAE) acoplada a um detector UV/VIS para detectar as moléculas que estão solubilizadas nestes extratos, principalmente a artepilina C que é característica de própolis verdes. Entretanto, a aparelhagem requerida é cara e a artepilina C pode ser determinada juntamente com outras substâncias, prejudicando a quantificação.
No presente trabalho são apresentados os resultados da busca de um MQ para a própolis de alecrim-do-campo. Foi utilizada a cromatografia gasosa (CG) como ferramenta de trabalho porque moléculas voláteis presentes na própolis trazem informações das plantas visitadas pelas abelhas e esta técnica é muito sensível, simples, rápida e barata para se alcançar este objetivo. Além disso, encontrado o MQ e estabelecidas as condições de operação, um simples cromatógrafo a gás poderá ser utilizado na análise.
Metodologia
Origem das amostras
As amostras de própolis foram coletadas em diversas cidades de Minas Gerais: Santa Bárbara, Perdões, Coromandel, São Gotardo, Nepomuceno, Divinópolis, Betim, Uberlândia, Três Marias, Indianópolis, Tripuí, Ouro Preto e Pelotas (Rio Grande do Sul); o broto e folha de alecrim-do-campo foram coletados em Perdões. Todas foram armazenadas a uma temperatura de -10 oC.
Extratos em diclorometano
Os extratos em diclorometano foram obtidos dissolvendo-se, em um frasquinho fechado, aproximadamente 0,10 g de própolis em 1,0 mL de solvente, por 1 h, com agitação periódica, e filtração com filtro de papel.
Cromatografia gasosa
A análise de CG do extrato em diclorometano foi feita em um aparelho da marca Shimadzu, modelo GC-17A; coluna capilar DB-5 de 30 m, 0,25 mm de d.i. e 0,25 µm de filme; programa de temperatura: 60 oC - 240 oC (3 oC min-1 e mantida por 20 min); injetor a 220 oC e detetor a 240 oC; pressão da coluna: 135 Kpa; fluxo do gás de arraste: 2,2 mL/min; razão do split 20; fluxo total de 50,7 mL; foi usado um detetor de massas da mesma marca, modelo QP-5000.
Resultados e discussão
A Figura 1a apresenta o cromatograma do extrato em diclorometano do broto de alecrim-do-campo. O composto mais abundante indicado pela seta em 39 minutos é o nerolidol. A outra seta destaca o composto de massa molar 256, denominado de MQ, que corre por volta de 55 minutos.
A Figura 1b mostra o cromatograma do extrato em diclorometano da folha de alecrim-do-campo. O composto mais abundante já não é o nerolidol e sim o germacreno-d que corre a 36 minutos e que também está presente no extrato do broto de alecrim-do-campo, só que em menor concentração. Neste cromatograma é destacado também o composto MQ que no extrato da folha está presente em baixa concentração.
A Figura 1c apresenta o cromatograma do óleo essencial do broto de alecrim-do-campo. Os compostos em destaque são o nerolidol e o MQ; este se encontra em baixa concentração no óleo essencial.
A Figura 1d mostra o cromatograma do extrato em diclorometano da própolis verde de Santa Bárbara (PSB). O composto mais abundante neste extrato é o MQ; o nerolidol é apenas o quarto mais abundante.
A análise da Figura 1 mostra claramente que o cromatograma do extrato em diclorometano da própolis PSB é mais rico em componentes de maior massa que os anteriores, principalmente o do óleo essencial. Na própolis praticamente não existem os monoterpenos cujo tempo de retenção vai até 25 minutos. Isto é devido à perda de constituintes mais voláteis durante o processo de preparação da própolis pelas abelhas. Outra observação importante que se pode obter da análise da Figura 1 é que o nerolidol se destaca nas quatro amostras, mas na própolis o componente mais proeminente é o MQ que está presente também nas demais amostras.
Há grande concordância na composição dos extratos do broto de alecrim e da própolis PSB, confirmando que a fonte vegetal mais importante para a preparação da própolis verde é Baccharis dracunculifolia.
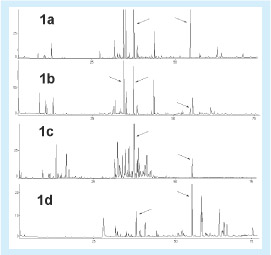
Figura 1. Cromatogramas dos extratos em diclorometano do broto de alecrim-do-campo- (a), folha de alecrim-do-campo (b), óleo essencial do broto de alecrim-do-campo (c) e do extrato em diclorometano da própolis PSB (d). Os compostos destacados por uma seta em 36, 39 e 55 minutos são, o germacreno-d, o nerolidol e o MQ, respectivamente.
A Figura 2a-f apresenta os cromatogramas de extratos em diclorometano de algumas própolis verdes mineiras de diferentes procedências. O composto MQ é destacado por uma seta. A análise das Figuras 1d e 2a-f permite inferir que o composto MQ é o mais abundante em todas as própolis verdes provenientes de regiões onde há alecrim-do-campo. Esse composto tem presença significativa no extrato do broto de alecrim, mas está presente em pequena concentração no extrato em diclorometano das folhas e no óleo essencial do broto desta planta (Figura 1a, 1b, 1c, respectivamente).
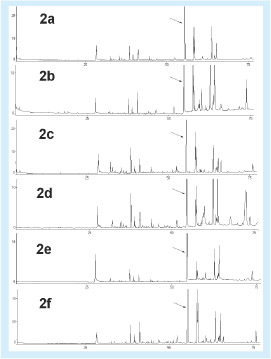
Figura 2. Cromatogramas dos extratos em diclorometano da própolis verde de Perdões (a), própolis verde de Coromandel (b), própolis verde de São Gotardo (c), própolis verde de Nepomuceno (d), própolis verde de Divinópolis (e), própolis verde de Betim (f). O composto MQ é destacado por uma seta.
A análise dos cromatogramas dos extratos em diclorometano das diferentes própolis verdes (Figuras 1d e 2a-f) permite concluir também que eles são bem parecidos, o que mostra que as abelhas são muito seletivas e que preferencialmente buscam o alecrim-do-campo nas regiões consideradas. O fato de o composto MQ não ser o mais abundante no extrato em diclorometano do alecrim-do-campo e sim nos extratos em diclorometano das própolis verdes sugere que, durante o processo de elaboração da própolis pelas abelhas, substâncias como o nerolidol, o germacreno-d, entre outras, são parcialmente decompostas ou volatilizadas.
A Figura 3 apresenta os cromatogramas de amostras de própolis não-verdes de diferentes procedências. Os cromatogramas mostram que o composto MQ está ausente na própolis marrom de Uberlândia (região sem alecrim) e continua presente em própolis de regiões que contêm alecrim, embora a própolis não seja a verde, sendo que na própolis marrom de Coromandel e na verde-marrom de Três Marias ele é tão abundante ou mais do que em algumas própolis verdes. Este resultado é surpreendente porquanto se supunha que própolis que contivessem alecrim-do-campo fossem sempre verdes. Certamente que resinas ou vegetais de coloração marrom do local atraíram também as abelhas. A presença de mais de 10% de fragmentos vegetais de outras fontes é suficiente para mudar a coloração da própolis verde, talvez devido à forma diferente de como as resinas foram coletadas nestas plantas ou à interação entre estas resinas ou à degradação ou à coloração diferente desses vegetais. Este tipo de própolis foi denominado de constituição mista3-4.
Outras amostras de própolis preta, amarela e vermelha provenientes de região ricas em alecrim apresentaram também o MQ, e a própolis de Pelotas, Rio Grande do Sul (região sem alecrim) não apresentou o MQ (Figura não mostrada).
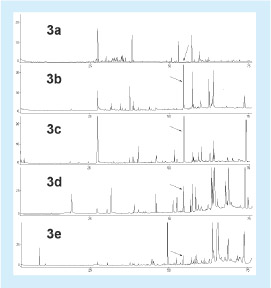
Figura 3. Cromatogramas dos extratos em diclorometano da própolis marrom da região de Bom Jardim, Uberlândia (a), própolis marrom de Coromandel (b), própolis verde-marrom de Três Marias (c), própolis marrom-escura de Indianópolis (d) e própolis marrom-escura de Tripuí (e). O composto MQ é destacado por uma seta.
Os resultados apresentados acima mostram que as própolis de locais que contêm alecrim-do-campo possuem o marcador químico MQ. Os resultados da análise de espectrometria de massas e do tempo de retenção na coluna DB-5 para o MQ são os seguintes:.
- EM: m/z 256 [M]+ (52 %), 201 (66 %), 185 (74 %), 157 (47 %), 145 (100 %), 128 (27 %), 115 (41 %), 91 (33 %) e 69 (32 %).
- tempo de retenção: 55 minutos.
Os dados acima são coerentes com a estrutura do composto 3-prenilcinamato de alila recentemente isolado da própolis verde17 (Figura 4).
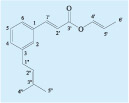
Figura 4. Estrutura
do 3-prenilcinamato
de alila
Conclusões
O composto volátil mais abundante do extrato em diclorometano de própolis verdes é o 3-prenilcinamato de alila que é facilmente detetável via cromatografia gasosa e pode servir como marcador químico deste tipo de própolis. Ele tem um tempo de retenção de 55 minutos, nas condições empregadas na análise cromatográfica deste trabalho.
Amostras de própolis marrons, preta e vermelha, provenientes de regiões onde há alecrim-do-campo, contêm também o marcador químico MQ em diferentes concentrações, segundo a abundância de alecrim-do-campo na região, sendo que algumas delas possuem maior concentração do marcador químico do que a própria própolis verde. Este dado é importante porque estas própolis são consideradas de segunda qualidade.
Agradecimentos
A Dra. E. M. Bastos (FUNED - BH), pelas amostras de própolis marrom de Tripuí e preta de Ouro Preto e sugestões; aos Apiários Mackllani (Santa Bárbara), Girassol e Santa Rita (Uberlândia), Alecrim Dourado (Perdões), Naturapis (Divinópolis) e Cia da Abelha (Contagem) e aos apicultores Ana Paula Veiga (Nepomuceno), João Batista de Almeida (Carrancas), Júnior Reis Souto (Coromandel), pelas outras amostras de própolis. Ao CNPq pelas bolsas de mestrado (D. C. Reis) e de produtividade em pesquisa (D. P. Veloso)
Referências
1.Ghisalberti, E. L.; Bee World 1979, 60, 59.
2. Marcucci, M. C.; Quim. Nova 1996, 19, 529.
3.Oliveira, V. D. C; Bastos, E. M.; Acta Bot. Bras. 1998, 12, 431.
4.Bastos, E. M.; Resumos do VI Congresso Latino Americano de Apicultura, México. 1998. Bastos, E. M.; Oliveira, V. D. C; Soares, A. E. E.; Honeybee Sci. 2000, 21, 179. Bastos, E. M.; Revista Minas Faz Ciência dez 2001 a fev 2002, 9, FAPEMIG - MG. Bastos, E. M.; Tese de Doutorado, Universidade de São Paulo, Ribeirão Preto, Brasil, 2001.
5.Park, Y. K.; Ikegaki, M.; Alencar, S. M.; Moura, F. F.; Honeybee Sci. 2000, 21, 85.
6.Nascimento, A. V. Jr.; Própolis Verde - Produção, Mercado, Tendências e Padronização. Palestra no Primeiro Seminário Apícola sobre Própolis Verde. Muzambinho - MG, Brasil, agosto, 2005.
7.Pereira, A. S.; Ramos, M. F. S.; Poças, E. S. C.; Dias, P. C. M.; Santos, E. P.; Silva, J. F. M.; Cardoso, J. N.; Aquino Neto, F. R.; Z. Naturforsch. 1999, 54c, 117.
8.Park, Y. K.; Paredez-Guzman, J. F.; Aguiar, C. L.; Alencar, S. M.; Fujiwara, F. Y.; J. Ag. Food Chem. 2004, 52, 1100.
9. Neto, F. R. A.; Pereira, A. S.; Nascimento E. A.; Z. Naturforsch. 2002, 57, 721.
10. Sawaya, A. C. H. F.; Tomazela, D. M.; Cunha; I. B. S.; Bankova, V. S.; Marcucci, M. C.; Custódio, A. R.; Eberlin, M. N.; Analyst 2004, 129, 739.
11. Nascimento, E. A.; Bezzan, L. C. F.; Mensagem Doce 2001, 63, 7. Nascimento, E. A.; Morais, S. A. L.; Bezzan, L. C. F.; Chang. R.; Rev. Ci. & Eng.. 2003, 37, 84. Nascimento, E. A.; Bezzan, L. C. F.; Chang, R.; Morais, S. A. L.; Vallejo, M. C. G.; Rev. Ci. & Eng. 2003, 12, 15.
12. Marcucci, M. C.; Ferreres, F.; Garcia-Viguera, C.; Bankova, V. S.; De Castro, S. L.; Dantas, A. P.; Valente, P. H. M.; Paulino, N.; J. Ethnopharm. 2001, 74, 105.
13. Cunha, I. B. S.; Sawaya, A. C. H. F.; Caetano, F. M.; Shimizu, M. T.; Marcucci, M. C.; Drezza, F. T.; Povia, G. S.; Carvalho, P. G. O.; J. Braz. Chem. Soc. 2004, 15, 964.
14.Midorikawa, K.; Banskota, A. H.; Tezuka, Y.; Nagaoka, T.; Matsushige, K.; Message, D.; Huertas, A. A. G.; Kadota, S.; Phytochem. Anal. 2001, 12, 366.
15. Kumazawa, S.; Yoneda, M.; Shibata, I.; Kanaeda, J.; Hamasaka, T.; Nakayama, T.; Chem. Pharm. Bull. 2003, 51, 740.
16. Bankova, V.; Boudourova-Krasteva, G.; Sforcin, J. M.; Frete, X.; Kujumgiev, A.; Maimoni-Rodella, R.; Popov, S. Z.; Naturforsch. 1999, 54c, 401.
17.Negri, G.; Salatino, M. L. F.; Sssalatino, A. J. Apic. Res. 2003, 42, 39.