Artigo
Própolis tipificada: um novo caminho para a elaboração de medicamentos de origem natural, contendo este produto apícola
Maria Cristina Marcucci1, Angela Ramalho Custódio2 e Regina Mara Silva Pereira111 Universidade Bandeirante de São Paulo, Pós-graduação em Farmácia, Rua Maria Cândida, 1813, São Paulo, SP, 02071-013, e-mail: crismarcucci@naturalab.com.br.
2 Natural Labor Análises e Pesquisas Ltda., Rua Lauro Vanucci, 1020, Jardim Santa Cândida, Campinas, SP, 13087-458.
Resumo
Foi desenvolvido um processo químico de tipificação de várias substâncias químicas presentes na própolis brasileira, empregando-se a técnica de cromatografia líquida de alta eficiência (CLAE) identificando-se e quantificando-se com precisão os diferentes compostos presentes. Estabeleceu-se um processo de separação por cromatografia líquida capaz de identificar os componentes majoritários de amostras de própolis (marcadores principais). Com base nos resultados obtidos através da investigação de centenas de amostras, foram estabelecidas metodologias de análise química de própolis brasileiras para um controle de qualidade. Através da técnica de CLAE e quantificação dos compostos identificados pela mesma, foi estabelecida uma tipificação para a própolis brasileira, baseando-se na presença de marcadores. O processo inclui a entrada de dados em uma planilha para a quantificação das substâncias identificadas por CLAE e também estabelece a tipagem da amostra pela quantidade de cada componente próprio da composição química da própolis brasileira. Com isto, abre-se um caminho para a utilização da própolis brasileira tipificada pela indústria farmacêutica. Palavras-chave: própolis tipificada, fenólicos, flavonóides.
Introdução
Nos últimos anos, a própolis de regiões tropicais, especialmente do Brasil, têm sido alvo de grande interesse econômico, sendo que o Japão é um dos maiores compradores mundiais deste produto brasileiro. Este fator economicamente importante levou muitos pesquisadores, principalmente japoneses, a investigar a própolis brasileira, sendo que se encontra atualmente, na literatura internacional, um número considerável de artigos científicos tratando deste produto brasileiro.
Fontes de própolis em zonas temperadas:
Os primeiros relatos sobre a análise de própolis baseados em evidências químicas surgiram na década de 70 quando Lavie (1975) na França e Popravko (1978) na Rússia identificaram a presença de flavonóides em própolis e compararam com a composição de exsudatos de choupo e bétula. Muitas outras publicações se seguiram a estas e hoje é aceito, através de comprovações químicas, que as principais fontes de própolis em zonas temperadas são os brotos e exsudatos de espécies de Populus (choupo) e seus híbridos. Estas informações foram amplamente confirmadas na Europa (Tamas et al., 1979; Popravko e Sokolov, 1980; Nagy et al., 1986; Greenaway et al., 1987; Bankova e Kuleva, 1989;), América do Norte (García-Viguera et al., 1993) e regiões não tropicais da Ásia (Bankova et al., 1992, Chi et al., 1996). Mesmo na Nova Zelândia, espécies de Populus lá introduzidas são a fonte visitada pelas abelhas (Markham et al., 1996). Na Rússia, especialmente nas regiões do norte, são espécies de bétula (Betula verrucosa) as preferidas pelas abelhas (Popravko e Sokolov, 1980). As amostras de própolis originadas destas regiões têm uma composição química muito similar e os principais constituintes são: flavonóides agliconas, ácidos aromáticos e seus ésteres (Marcucci, 1995).
Fontes de própolis em zonas tropicais:
Em regiões tropicais não existem espécies de choupo e bétula e as abelhas visitam outras plantas, por isto, a composição química de amostras de tais regiões é muito distinta das de zonas temperadas (Bankova et al., 2000). Investigações sobre esta resina em regiões tropicais revelaram que, em muitos casos, os flavonóides são os principais componentes destas amostras, similarmente às Européias, embora a sua origem vegetal seja diferente. Por exemplo, em amostras do deserto de Sonora, Wollenweber e Buchmann (1997) identificaram alguns flavonóides agliconas típicos de exsudatos da planta Ambrosia deltoidea: 3,5,7-triidroxi-3,8-dimetoxiflavona, xantomicrol, hispidulina, sideritiflavona, canferol, quercetina, ramnazina e outros componentes em menor concentração. Miricetina 3,7,4',5'-tetrametil éter e quercetina 3,7,3'-trimetil éter foram isolados da própolis da Tunísia, originando-se de exsudatos de folhas de algumas espécies de Citrus (Martos et al., 1997).
Nas amostras brasileiras, poucos flavonóides foram identificados, tais como: canferide, 5,6,7-triidroxi-3,4'-diidroxiflavona, aromadendrina-4-metil éter (Boudorova-Kravsteva et al., 1997), pinobanksina e um derivado de canferol (Marcucci et al., 2000a) o qual foi posteriormente confirmado como sendo o canferide (Marcucci et al., 2005) além de crisina e galangina. Nestas amostras, por outro lado, foram identificados outros compostos novos, que possuem uma atividade biológica marcante (Bankova et al., 2000). Uma classe de fenólicos, os ácidos p-cumáricos prenilados foram encontrados em grande quantidade em amostras brasileiras (Aga et al., 1994; Boudorova-Kravsteva et al., 1997), ácido 3-prenil-4-hidroxicinâmico (PHCA), 9-E- e 9-Z-2,2-dimetil-6-carboxietenil-8-prenil-2H-1-benzopirano (DCBEN) (Marcucci, 1996), ácido 3,5-diprenil-4-hidroxicinâmico (DHCA) e ácido 2,2-dimetil-8-prenil-2H-1-benzopirano-6-propenóico (DPB). Os compostos acima relatados, PHCA, DCBEN, DHCA e DPB, vanilina (G1), 3-metoxi-4-hidroxicinamaldeído (G2), 2 - [1 - hidroximetil] - vinil - 6 - acetil - 5 -hidroxicumarano (I) (originário de Baccharis truncata) (Marcucci et al., 2001) e os desconhecidos: H, K, L1, L2, M e N foram isolados pela autora (Marcucci, 1996). Alguns destes compostos possuem atividade antimicrobiana e antitumoral (Aga et al., 1994, Banskota et al., 1998). Os flavonóides estão praticamente ausentes nestas amostras (Bankova et al., 1995).
Através do estudo da composição química da própolis, foi possível dividi-las, segundo a sua origem, em grandes regiões geográficas, que podem ser englobadas em três grupos principais, e que são caracterizados por estas metodologias já mencionadas. Desta maneira, pode-se delinear um perfil químico de diferentes amostras e estabelecer padrões de qualidade. A tabela I mostra os compostos presentes em própolis de diferentes locais.
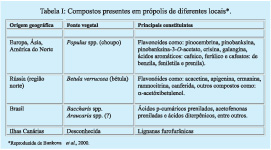
Além dos compostos descritos até o presente momento, vários outros foram identificados e avaliados quanto à sua atividade biológica (Banskota et al., 1998, 2000a, 2000b, 2001a, 2001b, Marcucci et al., 2001, Midorikawa et al., 2001, Nagaoka et al., 2001). Estes resultados descritos mostram as diferenças marcantes entre amostras brasileiras e as de várias outras partes do mundo (Tabela I). Portanto, era de extrema importância o desenvolvimento de um ou mais métodos de análise das própolis brasileiras (De Castro, 2001).
Materiais e métodos
Propolis
As própolis foram coletadas de diferentes partes no Brasil, perfazendo um total de 200 amostras que apresentavam perfis cromatográficos similares.
Processo de separação e identificação:
O processo consistiu em extrair o material bruto, colhido por raspagem de colméias racionais. Uma quantidade do material (variando de 50 a 150 mg) foi solubilizada em metanol a quente (volume variando entre 1,0 a 5,0 mL) filtrada em papel de filtro e passada por um filtro Millipore (0,45µ da Sartorius) para posteriores análises. Quando as amostras eram líquidas, foram empregadas tal qual estavam, utilizando-se apenas um fator de diluição das mesmas, a saber: 1, 2, 3,...10% em relação ao extrato original.
CLAE
As análises foram desenvolvidas em um cromatógrafo líquido com rede de fotodiodos e injetor automático. As condições cromatográficas utilizadas foram: fase móvel água-ácido fórmico (Merck) (95:5, solvente A) e metanol grau cromatográfico (Merck) (solvente B). A eluição foi desenvolvida em um fluxo de 1mL/min utilizando-se um gradiente linear. O tempo máximo de análise foi de 50 minutos e a detecção efetuada em comprimentos de onda de 280 e 340nm. Empregou-se um software apropriado para interpretação dos resultados obtidos (TIP®).
Análise estatística multivariada
Na análise quimiométrica, os dados processados são representados por uma matriz X. No presente estudo, as linhas representam as amostras de própolis enquanto cada coluna (p) representa as variáveis (por exemplo, os compostos presentes na própolis). As amostras de própolis são representadas como pontos no espaço dimensional. Portanto, um dos objetivos desta análise é justamente reduzir o espaço para duas ou três dimensões, que é a limitação humana para identificar, classificar e reconhecer objetos.
A matriz T chamada de "scores" representa a posição de uma amostra nesse novo espaço. A matriz V chamada de "loadings" representa uma matriz que descreve o peso de cada variáveis nesse novo eixo de coordenadas (conhecido como coordenadas principais, PCs), neste caso, os componentes químicos (marcadores). No presente trabalho, foi empregada na análise multivariada, o software Pirouette, versão 2.60, da Infometrix, Woodinville, WA, EUA.
Resultados e Discussão
Após a análise cromatográfica por CLAE as amostras foram quantificadas, analisadas através da quimiometria e divididas em quatro grupos principais. Um gráfico destes dados produziu uma rápida visualização das similaridades ou diferenças apresentadas pelas amostras, em função das variáveis. Portanto, neste estudo, aplicou-se a análise multivariada para descrever as correlações entre os diferentes tipos de própolis, em função dos principais compostos químicos (marcadores) encontrado por CLAE. As figuras 1A e 1B mostram a dispersão das amostras e das variáveis. Observa-se que existem quatro tipos de própolis distintos, ou seja, com marcadores diferentes. O tipo BRG (fig. 1A) é caracterizado por apresentar os marcadores G1, G2 e I (fig. 2B). O tipo BRP(PR) (fig. 1A) apresenta os compostos DCBEN, DPB e PHCA como marcadores principais (fig. 1B). O BRP(SP/MG) (fig. 1A) apresenta os marcadores principais CAF, DHCA e p-CUM (fig. 1B). O BRPG (fig. 1A) forma a interface entre os tipos BRP(PR) e BRG, com compostos destes dois grupos (fig. 1B).
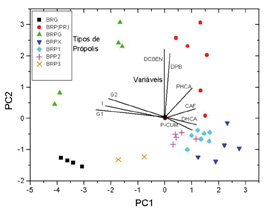
Figura 1- Análise das componentes principais
PC1 x PC2 onde são mostrados os compostos
identificados responsáveis pela separação.
Abreviaturas: CAF é o ácido cafeico, DHCA é o ácido 3,5-diprenil-4-hidroxicinâmico, DPB é o ácido 2,2-dimetil-8-prenil-2H-1-benzopirano-6-propenóico, PHCA é o ácido 3-prenil-4-hidroxicinâmico e P-CUM, o ácido p-cumárico, DCBEN, o 2,2-dimetil-6-carboxietenil-2H-1-benzopirano, G1 (vanilina), 2: G2 (3-metóxi-4-hidroxicinamaldeido), 3: I (2-[1-hidroximetil]-vinil-6-acetil-5-hidroxicumarano).
Neste trabalho, a identificação dos tipos de própolis brasileiras foi também avaliada usando-se um outro método quimiométrico denominado de "análises hierárquicas de agrupamentos" (HCA). A figura 2 ilustra o dendograma das correlações entre as própolis.
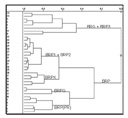
Figura 2 - Dendograma
para o conjunto de dados de
própolis de diferentes
origens geográficas(tipos)
empregando-se a construção
do tipo incremental.
Os melhores resultados foram aqueles com os dados autoescalados e mostram informações similares ao dos gráficos das análises das componentes principais(PC1 e PC2) (figura1). Observa-se aqui também uma separação entre os tipos de própolis BRP (BRP1, BRP2, BRPX, BRPG e BRP(PR)) e as do tipo BRG. Apenas as amostras do grupo BRP3 têm características similares às amostras do grupo BRG. Isso também é observado na análises das componentes principais. Isso deve-se ao fato de que a concentração dos componentes bioativos em ambos os casos seja baixa.
As própolis BRP têm as substâncias em comum (marcadores, a saber: os ácidos cafeico e cafeoilquínicos (CAF), p-cumárico (p-CUM), 3-prenil-4-hidroxicinâmico (PHCA) e e,5-diprenil-4-hidroxicinâmico (DHCA)) e por isso encontram-se no mesmo grupo, embora sejam sub-classificadas apenas pela quantidade dos marcadores. Já as amostras de própolis do tipo BRG apresentam as substâncias: vanilina (G1), 3-metóxi-4-hidroxicinamaldeido (G2) e 2-[1-hidroximetil]-vinil-6-acetil-5-hidroxicumarano (I), que caracterizam os marcadores destas própolis, separando-as do grupo BRP.
Na figura 3, observa-se a representação geográfica da tipagem. Nota-se que o tipo BRP aparece nos estados do sudeste, incluindo São Paulo, Minas Gerais e Rio de Janeiro. O tipo BRG aparece nos estados mais do sul do Brasil, a saber, Paraná, Santa Catarina e Rio Grande do Sul. Neste último, já começam a aparecer os flavonóides em maior concentração, como constituintes de resinas para a elaboração da própolis, já que o clima naquela região se assemelha ao de zonas temperadas da Europa. Portanto, as fontes vegetais parecem ser bem similares às da Europa, tais como o álamo. Ao que parece, quando a fonte vegetal do tipo BRP vai terminando (que é o alecrim) começa a aparecer uma nova fonte de resinas, as quais as abelhas misturam a do alecrim que é escassa, originando o tipo BRPG que é uma mescla dois dois tipos (BRP e BRG) com marcadores de ambos. Em contrapartida, as amostras BRP do Paraná apresentam um sub-marcador, que é o composto DCBEN, que está praticamente ausente nas própolis BRP da região que engloba São Paulo, Minas Gerais e Rio de Janeiro.
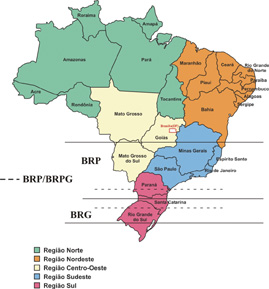
Figura 3: Representação geográfica da tipagem.
Estes são os tipos comercializados
(internamente ou exportação).
Através do método de CLAE, foi possível identificar os componentes majoritários existentes em própolis brasileiras. O grande problema hoje para se estabelecer um controle de qualidade correto e seguro sobre a composição das mesmas é a interpretação muitas vezes errônea da presença de flavonóides, que estão em amostras Americanas e Européias (Tabela I), cujas referências são empregadas aqui como padrão de qualidade e que se encontram praticamente ausentes em amostras brasileiras. Alguns dos compostos isolados e identificados, ora apresentados dão reação positiva com o cloreto de alumínio (reagente empregado na quantificação de flavonóides totais (metodologia empregada rotineiramente) e não são flavonóides, como o caso do composto I (2-[1-hidroximetil]-vinil-6-acetil-5-hidroxicumarano). Portanto a quantificação de flavonóides totais pela metodologia descrita (inspirada na Farmacopéia alemã) não é adequada para a quantificação de compostos presentes na própolis brasileiras, pois, conforme dito anteriormente, estes reagem positivamente ao teste, não sendo flavonóides.
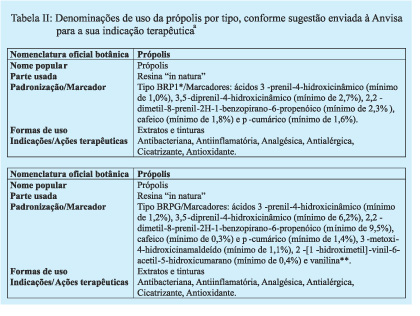
Recentemente a ANVISA divulgou no seu site uma nota técnica sobre o Registro de Produtos à base de própolis (Nota Técnica de 14 de setembro de 2005, www.anvisa.gov.br). Tal nota técnica é uma guia para o registro de produtos contendo própolis, os quais deverão atender requisitos mínimos de controle de qualidade, entre eles, a evidenciação da presença de marcadores que comprovem a sua origem.
Portanto, para os grupos caracterizados na cromatografia líquida, foi possível estabelecer um perfil baseado na ocorrência dos marcadores P-CUM, CAF, PHCA, DCBEN, DHCA, DPB, G1, G2 e I que podem servir como marcadores da própolis, caracterizada pela incidência destes compostos em praticamente todas as amostras analisadas. Concluiu-se que a própolis brasileira possui um marcador principal, isto é um componente majoritário que aparece na grande maioria das amostras analisadas, a saber, o ácido 3,5-diprenil-4-hidroxicinâmico (DHCA) denominado de Artepillin C® assim denominado pelos japoneses que já comercializam este composto na forma de pó e o empregam no tratamento de tumores. Este composto é o marcador da própolis brasileira dos tipos BRP e BRPG. Um grupo de amostras similares, distinto do primeiro, onde se encontram os compostos G1, G2, I, entre outros, é constituído de própolis tipicamente do Sul do Brasil, denominado de BRG.
A principal característica desta tipificação é que possibilitará a agilização do mercado deste produto apícola, desde o campo até à indústria farmacêutica e cosmética, favorecendo a estas utilizarem a tipificação para a confecção dos seus medicamentos e cosméticos, com controle de qualidade estabelecido, já que todos estes marcadores foram separados nos tipos por faixas de concentração. Isto é, a classificação é quantitativa. Todos os resultados aqui apresentados empregando-se a cromatografia líquida de alta eficiência, foram comprovados por CLAE-EM (espectrometria de massas) empregando-se também uma análise por fingerprint de massas (Sawaya, 2006).
O outro fator importante da tipificação é que será possível confeccionar produtos farmacêuticos, cosméticos e de higiene oral, conhecendo-se o tipo de própolis empregada e as quantidades dos componentes bioativos presentes, características nunca antes relatadas em publicações e patentes sobre própolis.
Agradecimentos
As autoras agradecem à Fundação de Amparo à Pesquisa do Estado de São Paulo, pelo auxílio financeiro (Proc. Fapesp no. 00/10031-0).
Nota: Uma das autoras deste trabalho (Marcucci, MC) esteve como convidada da reunião da Câmara Técnica de Fitoterápicos da Anvisa para a discussão sobre a elaboração da Nota Técnica para Registro de Produtos à base de Própolis, realizada nos dias 09 e 10 de setembro de 2005.
Nota: Este trabalho foi primeiramente publicado na revista FITOS (M.C.Marcucci, Própolis Tipificada: Um Novo Caminho Para a Elaboração de Medicamentos de Origem Natural, Contendo este Produto Apícola, Fitos, v.1, no.3, p. 36-46 (2006) (ISSN: 1808-9569)) e adaptado para esta publicação, com permissão do editor.
Referências
Aga, H., Shibuya, T., Sugimoto, T., Kurimoto, M., Nakajima, Sh. (1994) Isolation and identification of antimicrobial compounds in Brazilian propolis, Bioscience Biotechnology and Biochemistry, v.58, p.945-946.
Bankova, V., Kuleva, L. (1989) Phenolic compounds of propolis from different regions of Bulgaria, Animal Science, v.26, p.94-98 (em búlgaro).
Bankova, V., Dyulgerov, A., Popov, S., Evstatieva, L., Kuleva, L., Pureb, O., Zamjansan, Z. (1992) Propolis produced in Bulgaria and Mongolia:phenolic composition and plant origin, Apidologie, v.23, p.79-85.
Bankova, V., Christov, R., Kujumgiev, A., Marcucci, M.C., Popov, S. (1995) Chemical composition and antibacterial activity of Brazilian propolis, Zeischrift fur Naturforschung, v.50C, p.167-172.
Bankova, V., Nikolova, N., Marcucci, M.C. (1996) A new lignan from Brazilian propolis, Zeischrift fur Naturforschung, v.51B, p.735-737.
Bankova, V.S., De Castro, S.L., Marcucci, M.C. (2000) Propolis: recent advances and plant origin, Apidologie, v.31, p.3-15.
Banskota, A.H., Tezuka, Y., Prasain, J.K., Matsushige, K., Dsaiki, L., Kadota, Sh. (1998) Chemical constituents of Brazilian propolis and their cytotoxic activities, Journal of Natural Products, v.61, p.896-900.
Banskota, A.H., Tezuka, Y., Adnyana, K., Midorikawa, K., Matsushige, K., Message, D., Huertas, A.A.G., Kadota, S. (2000a) Cytotoxic hepatoprotective and free radical scavenging effects of propolis from Brazil, Peru, the Netherlands and China, Journal of Ethnopharmacology, v.72, p.239-246.
Banskota, A.H., Tezuka, Y., Midorikawa, K., Matsushige, K., Kadota, S. (2000b) Two novel cytotoxic benzofuran derivatives from Brazilian propolis, Journal of Natural Products, v.63, p.1277-1279.
Banskota, A.H., Tezuka, Y., Adnyana, I.K., Ishii, E., Midorikawa, K., Matsushige, K., Kadota, S. (2001a) Hepatoprotective and anti Helicobacter pylori activities of constituents from Brazilian propolis. Phytomedicine v.8, p.16-23.
Banskota, A.H., Tezuka, Y., Kadota, S. (2001b) Recent progress in pharmacological research of propolis. Phytotheraphy Research v.15, p.561-571.
Boudorova-Kravsteva, G., Bankova, V., Sforcin, J.M., Nikolova, N., Popov, S. (1997) Phenolics from Brazilian propolis, Zeistchrift furNaturforschung, v.52C, p.676-679.
Chi, J., Xue, B., Chen, H. (1996) The chemical constituents of flavonoids from Liaoxi propolis, Zhangguo Yaoxue Zazhi v.31, p.264-266 (em chinês).
De Castro, S.L. (2001) Propolis: biological and pharmacological activities. Therapeutic uses of this bee-product, Annual Review of Biomedical Sciences, v.3, p.49-83.
García-Viguera, C., Ferreres, F., Tomás-Barberán, F.A. (1993) Study of Canadian propolis by GC-MS and HPLC, Zeistchrift furNaturforschung, v.48C, p.731-735.
Greenaway, W., Scaysbrook, T, Whatley, F.R. (1987) The analysis of bud exudate of Populus x euramericana and of propolis, by gas chromatography-mass spectrometry, Proceedings of Royal Society of London B, v.232, p.249-272.
Lavie, P. (1976) The relationship between propolis, poplar buds (Populus spp.) and castoreum, Proc. XXV International Beekeeping Congress, Grenoble, 1975, Apimondia Publication House, Bucharest, p.229-233.
Marcucci, M.C. (1995) Propolis: chemical composition, biological properties and therapeutical activity, Apidologie, v.26, p.83-99.
Marcucci, M.C. (1996) Relatório de Pós-doutoramento no exterior, Proc.Fapesp no. 94/03686-8.
Marcucci, M.C., Ferreres, F., Custódio, A.R., Ferreira, M.M.C., Bankova, V.S., García-Viguera, C., Bretz, W.A. (2000) Evaluation of Phenolic Compounds in Brazilian Propolis from Different Geographic Regions, Zeistchrift furNaturforschung, v.55C, p.76-81.
Marcucci, M.C., Ferreres, F., García-Viguera, C., Bankova, V.S., De Castro, S.L., Dantas, A.P., Valente, P.H.M., Paulino, N. (2001). Phenolic Compounds from Brazilian Propolis with Pharmacological Activities, Journal of Ethnopharmacology, v.74, p.105-112.
Marcucci, M.C., Sawaya, A.C.H.F, Custodio, A.R., Bankova, V.S., Ferreres, F., Eberlin, M.N. (2005) Resultados não publicados.
Markham, K.R., Mitchell, K.A., Wilkins, A.L., Daldy, J.A., Lu, Y. (1996) HPLC and CG-MS identification of the major organic constituents in New Zealand propolis, Phytochemistry, v.42, p.205-211.
Martos, I., Cossentini, M., Ferreres, F., Tomás-Barberán, F.A. (1997) Flavonoid composition of Tunisian honey and propolis, Journal of Agricultural and Food Chemistry, v.54, p. 2824-2829.
Midorikawa, K., Banskota, A.H., Tezuka, Y., Nagaoka, J., Matsushige, K., Message, D., Huertas, A.A.G., Kadota, S. (2001) Liquid chromatography-mass spectrometry analysis of propolis, Phytochemical Analysis, v.12, p.1-8.
Nagaoka, T., Banskota, A.H., Xiong, Q., Tezuka, Y., Kadota, S. (2001) Synthesis, antihepatotoxic and antiproliferative activities of di- and tri-O-caffeoylquinic acid derivatives, Journal of Tradicional Medicine v.18, p.183-190.
Nagy, E., Papay, V., Litkei, G., Dinya, Z. (1986) Investigation of the chemical constituents, particularly the flavonoid components of propolis and Populi gemma by the GC/MS method, Study of Organic Chemistry, v.23, p.223-232.
Popravko, S.A. (1978) Chemical composition of propolis, its origin and standardization, em: A Remarkable Hive Product: PROPOLIS, Apimondia Publication House, Bucharest, p.15-18.
Popravko, S.A., Sokolov, M.V. (1980) Plant sources of propolis, Pchelovodstvo v.2, p.28-29 (em russo).
Sawaya, A.C.H.F., Tese de doutorado, Instituto de Química, UNICAMP, setembro de 2006.
Tamas, M., Marinescu, I., Ionescu, F. (1979) Flavonoidele din muguri de plop, Study Cercet Biochimica, v.22, p.207-213.
Wollenweber, E., Buchmann, S.L. (1997) Feral honey bees in the Sonoran Desert: propolis sources other than poplar (Populus spp.), Zeistchrift furNaturforschung, v.52C, p.530-535.