Artigo
ESTUDO DAS PROPOLIS QUE CONTÉM ARTEPILLIN C
Paredes-Guzmán, J.1; Aguiar, C.L.1; Fujiwara, F.2 e Park. Y.K.*,1
1. Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Caixa Postal 6177, 13083-970, Campinas, São Paulo, Brasil
2. Instituto de Química, Universidade Estadual de Campinas, Caixa Postal 6154, 13083-970, Campinas, São Paulo, Brasil.
* Autor para correspondência. Telefone: +55-19-3788-2157. Fax: +55-19-3289-2153. E-mail: ykpark@fea.unicamp.br
1. Introdução
A própolis brasileira tem sido usado como ingrediente em alimentos funcionais, principalmente no Japão bem como nos Estados Unidos e Europa.
No Japão, há grande procura por própolis que contenham Artepillin C (ácido 3,5-diprenil-4-hidroxicinâmico), um composto químico inicialmente isolado de própolis brasileira, o qual tem despertado grande interesse devido às suas propriedades biológicas. As própolis brasileiras são rotuladas como um produto único ("Brazilian propolis") e a grande procura tem se dado em função da presença de Artepillin C, muito embora, trabalhos anteriores têm mostrado uma grande variedade na composição química das própolis brasileira, como os trabalhos de Park et al. [7, 8], quando classificaram a existência de no mínimo doze grupos diferentes de própolis no Brasil, de acordo com suas composições químicas e prevalência na região assim como suas propriedades biológicas. Estes trabalhos possibilitaram a identificação de três vegetais como sendo as origens botânicas de três grupos de própolis brasileira (G3, G6, G12).
As primeiras pesquisas relacionadas ao Artepillin C demonstraram sua atividade anti-tumoral, segundo Kimoto et al. citado por Uto et al. [1], pela promoção da apoptose [2] e cura da leucemia [3], favorecendo o aumento da resposta imunológica [4], além de apresentar atividade antimicrobiana [5] e antioxidante [6]. Por isso, a presença de Artepillin C em própolis brasileira nos diferentes grupos [7, 8, 9] foi avaliada em cerca de 600 amostras de própolis do Brasil, além de amostras do Perú, Argentina, Uruguai e Chile. No Brasil, as própolis foram classificadas em 12 grupos representativos de cada localidade associada às características botânicas [7]. Dos doze grupos de própolis brasileira analisada o Grupo 12 apresentou maior concentração, comparado a outro grupo (Grupo 5) que também continha Artepillin C. Foram testadas algumas amostras de própolis do Perú, sendo que algumas destas também continham aquele composto. A origem botânica das própolis do Grupo 12 foi Baccharis dracunculifolia [7].
A presença de Artepillin C nas amostras de própolis foi avaliada por diferentes técnicas analíticas, tais como: espectro de absorção na região UV-visível, CCDAE, CLAE-FR e RMN, que serão discutidas a seguir.
Logo o objetivo deste trabalho foi identificar Artepillin C em várias amostras de própolis procedentes de diferentes regiões sul-americanas.
2.Material e Métodos
2.1.Preparo das amostras
Para o preparo dos extratos etanólicos de própolis (EEP) foram pesados, em balança analítica, dois gramas da própolis triturada, e a extração foi feita com etanol 80% (Merck p.a.), a 70°C, em banho de água termostatizado, por 30 min, sob agitação constante, seguidamente será centrifugada a 8000 rpm por 10 min, em centrífuga refrigerada Beckman J2-21 (5°C), de acordo com o método descrito por Park et al. [10].
2.2.Espectrofotômetro de absorção
Para a determinação do espectro de absorção máxima dos EEP, usou-se um método modificado proposto por Park et al. [10]. Alíquotas de 12,5 ?l do extrato foram diluídas em 15 mL de etanol (80%) e, o espectro de absorção na região UV-Visível das amostras foi determinado na faixa entre 200 a 600 nm ("U.V. scanning") utilizando espectrofotômetro Beckman Coulter DU-640.
2.3.Cromatografia em camada delgada de alta eficiência em fase reversa (CCDAE-FR)
A cromatografia em camada delgada de alta eficiência dos EEP foi feita de acordo com o método descrito por Park, et al. [11] e Park et al. [12]. Alíquotas de 3 ?l dos EEP foram aplicados em cromato placas RP 18 F254 S (Merck Co.). O tempo de desenvolvimento do cromatograma foi de aproximadamente 80 minutos, utilizando-se como sistema solvente, etanol:água destilada (55:45, v/v). As placas desenvolvidas foram observadas sob luz ultravioleta nos comprimentos de onda de 254 e 366 nm, utilizando iluminador U.V. Cole Palmer, modelo UPV-UVGL-58.
2.4.Cromatografia líquida de alta eficiência em fase reversa (CLAE-FR)
As análises dos EEP por CLAE em fase reversa foram feitas de acordo com o método modificado por Park et al. [11] e Koo et al. [13]. Vinte microlitros dos EEP foram injetados em cromatógrafo líquido de alta eficiência com detector de arranjo de fotodiodos e uma coluna de fase reversa YMC Pack ODS-A (250 x 4,6 mm). A fase móvel utilizada foi água/ácido acético (19:1, v/v) (solvente A) e metanol (solvente B), com fluxo constante de 1 ml/min e a leitura foi feita a 254 nm. O gradiente iniciou com 30% do solvente B até 40% de B em 15 min, 50% de B em 50% em 30 min, 60% de B em 45 min, 75% de B em 65 min, 75% de B em 85 min, 90% de B em 95 min e 30% de B em 105 min. A coluna foi mantida à 35°C e os cromatogramas foram processados utilizando "software" específico. Os compostos eluídos foram analisados pelos espectros de adsorção na região ultravioleta (200 - 400 nm), utilizando os recursos do detector SPD-M10A (Shimadzu Co.) e co-cromatografia contra padrões autênticos.
2.5.Ressonância Magnética Nuclear
O espectro 1H-MNR foi obtido em um espectrômetro Varian Inova a 500 MHz usando tubos de 5 mm. Os EEP foram secos e dissolvidos em CDCl3 e, tetrametilsilano foi usado como referência.
3.Resultados e Discussão
Própolis tem sido muito pesquisada e sua composição química tem mostrado uma grande quantidade de compostos químicos [15, 16], dos quais poucos foram identificados e tão pouco suas atividades fisiológicas ou farmacológicas estudadas. No Japão, quase 90% das importações são de própolis brasileiras. As própolis que contenham alto teor de Artepillin C são consideradas como de melhor qualidade devido às própolis brasileiras serem extensamente usadas em alimentos e bebidas, com o propósito de manter ou melhorar a saúde humana [17].
Por esta razão, foram investigadas própolis brasileiras, principalmente dos Grupos 5 e 12, as quais apresentam Artepillin C (Figuras 1A, 1B). As própolis do Grupo 12 foram coletadas nos Estados de São Paulo, Mato Grosso do Sul, Goiás e sul de Minas Gerais. Foram investigados a origem botânica da própolis G12, para a qual Baccharis dracunculifolia (botão e folhas novas não expandidas) apresentam similares perfis cromatográficos. Artepillin C (Figura 1D), foi identificado tanto em Baccharis dracunculifolia macho quanto na fêmea. Os perfis cromatográficos foram muito semelhantes entre eles e com as própolis do Grupo 12 (Figura 2). Em Seguida foram investigadas as própolis do Grupo 5, coletadas no Estado do Paraná, as quais também continham Artepillin C, além disso, foram investigados vários vegetais para determinação da origem botânica desta própolis. Para este grupo de própolis, Baccharis caprariaefolia A.P.DC. (Alecrim pluma) apresentou perfis cromatográficos similares ao da própolis G5, e em ambas as amostras foi percebido a presença de Artepillin C (Figura 1E). Outros vegetais estão sendo investigados para se confirmar a origem botánica das própolis do Grupo 5.
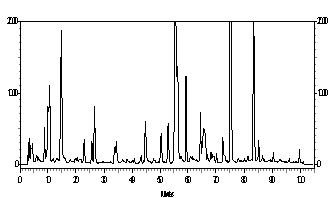 Figura 1. A - Própolis G - 12 |
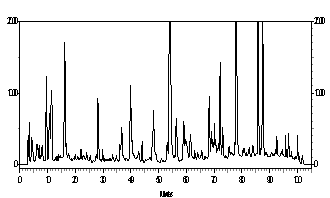 Figura 1. B - Própolis G - 5 |
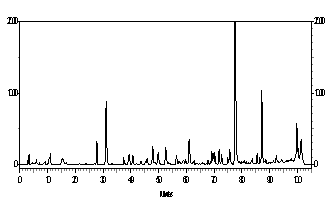 Figura 1. C - Própolis Perú - 1 |
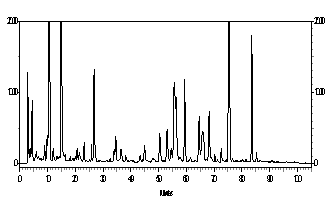 Figura 1. D - Baccharis dracunculifolia |
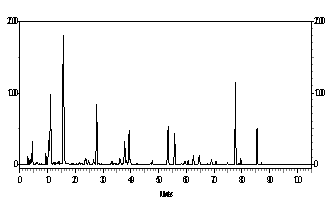 Figura 1. E - Baccharis caprariaefolia |
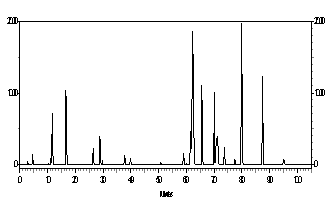 Figura 2 |
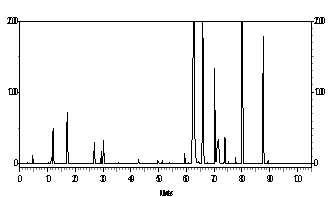 Figura 2 |
|
Recentemente foi pesquisado a presença de Artepillin C em amostras de própolis do Uruguai, Argentina e Perú. Uma amostra do litoral do Perú (Perú-1) contém Artepillin C (Figura 1C) numa concentração semelhante à da própolis do Grupo 12.
As propriedades fisiológicas como antimicrobiana e antioxidante têm sido estudadas, e a própolis do Grupo 12 tem ação semelhante à dos botões de Baccharis dracunculifolia. Quando comparado com a própolis Perú-1, achou-se também ação muito semelhante. Estas propriedades fisiológicas das própolis já foram feitas em estudos anteriores [5, 6] indicando a eficácia delas.
Os perfis apresentados na cromatografia de camada delgada de alta eficiência foram muito semelhantes para as amostras pesquisadas, logo para confirmar a presença do Artepillin C tanto na própolis do Grupo 12 como no Baccharis dracunculifolia, os extratos preparados e acondicionados, foram avaliados por ressonância magnética nuclear e, os resultados observados para o espectro do padrão de Artepillin C foram semelhantes aos do Baccharis dracunculifolia, bem como da própolis do Grupo-12. Estudos de pesquisadores como Aga et al. [5] e Tazawa et al. [14] que isolaram e identificaram o Artepillin C, nos indicam que este composto está presente nas própolis do Grupo 5 e 12, Perú-1, Baccharis dracunculifolia e Baccharis caprariaefolia A. P. DC. (Alecrim pluma).
4. Conclusão
De acordo com os resultados obtidos, conclui-se que o perfil de flavonóides e compostos fenólicos são semelhantes para a própolis do Grupo 12 e Baccharis dracunculifolia os quais foram confirmados por ressonância magnética nuclear. Nos testes de atividade biológica, notou-se que tanto para a atividade antimicrobiana quanto para antioxidante, a própolis do Grupo-12 foi muito semelhante com à Baccharis dracunculifolia. Os perfis de CLAE-FR mostraram que a própolis do Grupo-12 e Baccharis dracunculifolia também foram muito semelhantes, tanto em quantidade como em número de compostos, entretanto a própolis Perú-1 apresenta o Artepillin C quase na mesma concentração que da o Grupo-12, mais o número de compostos varia muito, sendo menor o número de compostos da própolis Perú-1. A análise das atividades antimicrobiana e antioxidante foi da mesma forma similares, no entanto, perfis cromatográficos foram distintos.
5. Bibliografia
Uto, Y.; Hirata, A.; Fujita, T.; Takubo, S.; Nagasawa, H.; Hori, H. J. Org. Chem. 67, 2355-2357, 2002.
Matsuno, T.; Jung, S.K.; Matsumoto, Y.; Saito, M.; Morikawa, J. Anticancer Research. 17 (5A) 3565-3568, 1997
Kimoto, T.; Aga, M.; Hino, K.; koya-Miyata, S.; Yamamoto, Y.; Micallef, M.J.; Anaya, T.; Arai, S.; Ikeda, M.; Kurimoto, M. Anticancer Research. 21(1A), 221-228, 2001.
Kimoto, T.; Arai, S.; Kohguchi, M.; Aga, M.; Nomura, Y.; Micallef, M.J.; Kurimoto, M.; Mito, K. Cancer Detect. Prev. 22(6), 506-15, 1998.
Aga, H.; Shibuya, T.; Sugimoto, T.; Kurimoto, M.; Nakajima, S. Biosci. Biotech. Biochem. 58(5), 945-946, 1994.
Hayashi, K.; Komura, S.; Isaji, N.; Ohishi, N.; Yagi, K. Chem. Pharm. Bull. 47 (11), 1521-1524, 1999.
Park. Y.K.; Alencar, S.M. Aguiar, C.L. J. Agric. Food Chem. 50, 2502-2506, 2002.
Park, Y.K.; Ikegaki, M.; Alencar, S.M. Honeybee Sci. 21 (2), 85-90, 2000.
Park, Y.K.; Ikegaki, M.; Alencar, S.M. Mensagem Doce, 58, 2-7, 2000.
Park, Y.K.; Ikegaki, M.; Abreu, J.A.; Alcici, N.M.F. Ciênc. Tecnol. Alim. 18(3), 313-318, 1998.
Park, Y.K.; Koo, M.H.; Ikegaki, M.; Contado, J.L. Arq. Biol. Tecnol. 40 (1), 97-106, 1997.
Park. Y.K.; Koo, M.H.; Sato, H.H.; Contado, J.L. Arq. Biol. Tecnol. 38 (4), 1253-1259, 1995.
Koo, H.M.; Rosalen, P.L.; Cury, J.A.; Ambrosano, G.M.B.; Murata, R.M.; Yatsuda, R.; Ikegaki, M.; Alencar, S.M.; Park, Y.K. Curr. Microbiol. 41 (3), 192-196, 2000.
Tazawa, S.; Tsutomu, W.; Noro, T.; Miyase, T. Chem. Pharm. Bull. 46(9), 1477-1479, 1998.
Marcucci, M.C. Química Nova. 19(5), 529-536, 1996.
Greenaway, W.; May, J.; Scaysbrook, T.; Whatley, F.R. Z. Naturforsch. 46c, 111-121, 1991.
Marcucci, M.C.; Ferres, F.; Garcia-Viguera, C.; Bankova, V.S.; De Castro, S.L.; Dantas, A.P.; Valente, P.H.M.; Paulino, N. J. Ethnopharm. 74, 105-112, 2001.