Aguiar, C.L.(1); Alencar, S.M.(2); Paredes-Guzmán, J.F.1; Koo, M.H.(3); Park, Y.K.1,(*))
1-Universidade Estadual de Campinas, Faculdade de Engenharia de Alimentos, Laboratório de Bioquímica de Alimentos, Caixa Postal 6121, 13083-970, Campinas, SP., Brasil.
2-Centro Federal de Educação Tecnológica do Paraná, Departamento de Agronomia, 85503-390, Pato Branco, PR., Brasil.
3-University of Rochester Medical Center, Center for Oral Biology, Aab Institute of Biomedical, 601 Elmwood Avenue Rochester, NY 14641, USA
*Autor para correspondência: Dr. Yong K. Park
Cx. P. 6177
13081-970, CAMPINAS, SP., BRASIL
Tel. 19-37882157
Fax. 19-3289-2832
E-mail: ykpark@fea.unicamp.br
Praticamente todas as civilizações antigas com as suas terapias milenares conheceram e utilizaram os produtos apícolas como valiosos recursos para sua medicina. A história das medicinas das civilizações Chinesa, Tibetana, Egípcia e Greco-romana é muito rica, todas contendo em seus escritos antigos centenas de receitas onde entravam principalmente mel, própolis, larvas de abelhas e, às vezes as próprias abelhas, para curar ou prevenir enfermidades. Alguns textos referem-se à própolis como Bálsamo de Gileade, utilizada para curar feridas e que atingia altos preços no mercado daquela época. Para Ghisalberti (1979) própolis é uma resina coletada por abelhas (Apis mellifera) de diversas partes das plantas como brotos, botões florais e exudados resinosos sendo transportados para dentro da colméia, vem se destacando tanto pelas suas propriedades terapêuticas, como atividade antimicrobiana, anti-inflamatória, cicatrizante, anestésica (Bankova et al., 1989; Bianchini & Bedendo, 1998; Ghisalberti, 1979; Khayyal et al., 1993; Kujumgiev et al., 1999), anticariogênica (Koo et al., 1999; Park et al., 1998c), antiviral, anticarcinogênica, antioxidante (Blair et al., 1958; Burdock, 1998; Marcucci, 1996) e fitotóxica (Ghisalberti, 1979; Johnson et al., 1994), quanto pela possibilidade de aplicação nas indústrias farmacêutica e alimentícia na forma de alimentos funcionais (Ackermann, 1991).
Existem relatos de que a própolis era utilizada farmacologicamente desde o final do século passado, principalmente na Romênia, Polônia, França, Alemanha, nas antigas Iugoslávia e Tcheco-Eslováquia e outros países europeus (Koo & Park, 1996). Foi constatado que em amostras de própolis européias a composição química é bastante similar, visto que as abelhas do hemisfério norte são muito seletivas na coleta de resinas, principalmente das espécies de Populus. Entretanto, a composição química das própolis produzidas na América do Sul é de especial interesse, pois nessa região é rara a ocorrência de Populus. Foi observada diferença na composição de compostos fenólicos de própolis de mesma origem floral de algumas regiões brasileiras (Koo & Park, 1997; Park et al., 1997; Park et al., 1995), sendo que o mesmo não foi observado em outros países (Sabatier et al., 1992). Análises de própolis oriundas do Brasil e da Venezuela confirmaram a presença de compostos incomuns, além dos flavonóides, nestas amostras com relação aos componentes das européias e do resto do mundo (Marcucci, 1995; Tomás-Barberán et al., 1993). Alguns compostos já foram identificados, sendo principalmente compostos fenólicos e, a maioria pertencente a três grupos principais: (I) flavonóides (flavonóis, flavonas e flavanonas), (II) ácidos fenólicos e (III) ésteres fenólicos e, suas concentrações variam dependendo da flora da região de coleta e a variabilidade genética da abelha (Koo & Park, 1996; Bonhevi et al., 1994; Park et al., 1998a; Bankova et al., 1992; Park et al., 1997; Koo & Park, 1997; Bankova et al., 1999).
No Japão, o uso da própolis teve grande desenvolvimento após 1985, sendo inclusive um dos principais compradores da própolis brasileira (Koo & Park, 1996), fato que contribui para que o Brasil seja um grande exportador mundial de própolis, com cerca de 90% do mercado.
Os estudos iniciais com própolis, realizados pela equipe de pesquisadores do Laboratório de Bioquímica de Alimentos, do Departamento de Ciências de Alimentos/UNICAMP, começaram durante um trabalho de investigação de leveduras osmofílicas de mel, produtoras de açúcares não-convencionais (Aoki et al., 1993; Park et al., 1998d; Park et al., 1998e; Park et al., 1996). Durante este trabalho, foi observado que as própolis coletadas apresentavam propriedades antimicrobianas, protegendo as caixas de abelhas contra ?invasores? microbianos (Koo et al., 2000a; Koo et al., 1999; Koo & Park, 1997; Marcucci, 1996; Park & Ikegaki, 1998; Park et al., 1998a; Park et al., 1998b; Park et al., 1998c; Park et al., 1997; Park et al., 1996; Park et al., 1995; Koo et al. 2000b; Koo et al. 2000c). Diversos estudos levaram à classificação das própolis em doze grupos principais, de acordo com a composição química básica dos extratos alcoólicos obtidos daquelas própolis. Destes grupos, o grupo 6 apresentou altas atividades antimicrobiana e antitumoral, e o grupo 1 se destacou pela elevada atividade anti-HIV, atestado pelo Bio Research Laboratories (Washington, EUA) (Ito et al., 2001). No entanto, um novo grupo de própolis da Região de Mata Atlântica de Alagoas, tem sido identificado e classificado (Grupo 13), a qual apresenta significativa atividade antimicrobiana contra Staplylococcus aureus ATCC 25923 coagulase positiva. Este trabalho teve como objetivo avaliar as características físico-químicas das própolis coletadas em diferentes locais da Mata Atlântica do Estado de Alagoas.
2. Material e Métodos
2.1 - Coleta das amostras
As amostras de própolis foram coletadas por raspagem das partes internas das caixas (melgueira e ninhos) de abelhas Apis mellifera de diferentes regiões do Estado de Alagoas.
2.2 - Extração alcoólica da própolis
Uma massa de própolis bruta foi triturada, peneirada e armazenada na forma de pó em geladeiras a 4ºC. Amostras de 2 gramas da própolis e 25 mL de etanol (80% ) foram transferidos para tubos de centrífuga e mantidos a 70°C por 30 minutos, sob agitação circular e constante. Após a extração, as amostras foram centrifugadas a 8800 x g por 10 minutos a 5°C. Os sobrenadantes (extratos etanólicos de própolis) foram armazenados a 4°C em tubos de ensaio (15 ( 160 mm) com tampa de rosca.
2.3 - Determinação do espectro de absorção dos extratos etanólicos de própolis
Alíquotas de 25 (L de cada extrato, obtido de acordo com o item 2.2, foram diluídas em 30 mL de etanol 80% e o espectro de absorção na região UV-visível das amostras foi determinado na faixa de 200 ? 600 nm (U. V. scanning) utilizando espectrofotômetro Beckman DU ? 640.
2.4 - Cromatografia em camada delgada de alta eficiência em fase reversa dos extratos de própolis
Foi realizado segundo método proposto por Park et al. (1997) e Park et al. (1996). Alíquotas do extrato de própolis serão aplicadas em cromatoplacas (10 ( 10 cm) RP-18 F254 S (Merck Co.). O tempo de desenvolvimento do cromatograma foi de 100 minutos aproximadamente, utilizando como sistema de solventes etanol:água (55:45, v/v). As placas desenvolvidas foram observadas sob luz ultra-violeta no comprimento de onda de 254 nm e 366 nm, utilizando iluminador U. V. Cole Parmer, modelo UVP-UVGL 58.
3. Resultados e Discussão
Atualmente, tem-se que alguns tipos de própolis são fruto da coleta de brotos apicais de determinadas plantas próximas às colméias das abelhas. Outro fator que foi elucidado por Park et al. (2002), é que as abelhas apresentam uma preferência na coleta por um vegetal daquela região para obtenção da própolis. Embora haja grande variedade vegetal, pôde-se verificar que algumas própolis possuíam uma composição química básica semelhante à de determinadas plantas no local de coleta, fato que levou a identificação de três vegetais como fonte da composição química de três grupos de própolis no território brasileiro, sendo um na região Sul, outro na região Nordeste e o último na região Sudeste.
Inicialmente, o perfil químico dos extratos etanólicos de própolis (EEP) foi analisado por cromatografia de camada delgada de alta eficiência em fase reversa (CCDAE-FR) e espectrofotometria na região ultravioleta-visível. Com base nestas técnicas, foram selecionados os tipos de própolis de grande ocorrência, os quais foram classificados e denominados de grupos de própolis. Ao todo foram encontrados doze grupos distintos (G1-G12), sendo que atualmente com a expansão das pesquisas em outras regiões brasileiras, novos grupos têm sido classificados, devido a existência de diferentes perfis cromatográficos das amostras destas regiões. Na Figura 1a são mostrados os extratos etanólicos dos doze grupos classificados por Park et al. (2000), onde a amostra SP1 representa a própolis da região Sudeste, que atualmente é a mais exportada para países como Japão e Estados Unidos. Na Figura 1b, são apresentados os perfis em CCDAE-FR sob radiação ultra-violeta (254 nm) de diferentes compostos fenólicos presentes nos extratos etanólicos de própolis, respectivamente.
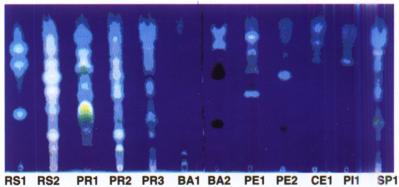
Figura 1. Aspecto físico dos EEP coletados em diferentes regiões do Brasil. Onde: RS = amostras do Rio Grande do Sul; PR = amostras do Paraná; BA = amostras da Bahia
As amostras de própolis da Mata Atlântica do Estado de Alagoas apresentaram um perfil cromatográfico diferenciado dos doze grupos de própolis classificados. Alguns estudos preliminares mostraram uma característica química peculiar destas amostras de própolis, e constatou-se que suas características física e química diferem das outras amostras de própolis até agora estudadas por nosso grupo de pesquisa. A Figura 2 mostra o aspecto físico das amostras de própolis de Alagoas, em forma bruta (Figura 2a) e dos EEP (Figura 2b).
As amostras de própolis apresentaram grande variedade de coloração na forma de EEP, como pode ser observado na Figura 2b. A coloração variou desde o amarelo pálido até o vermelho intenso. Um fato que tem sido observado nas amostras de própolis desta região do Estado de Alagoas é sua coloração tendendo ao vermelho. Um estudo tem sido feito no intuito de identificar a origem botânica destas própolis, onde se tem buscado vegetais cujas partes, como folhas, galhos ou caule, possam fornecer compostos químicos com intensa coloração avermelhada.
Segundo Bonvehí et al. (1994) a propolis contém principalmente compostos fenólicos, como aldeídos fenólicos, derivados de ácidos cinâmico e benzóico. Os flavonóides (flavonóis, flavonas ou flavanonas) contidos nas própolis são um dos principais responsáveis pelas atividades farmacológicas.
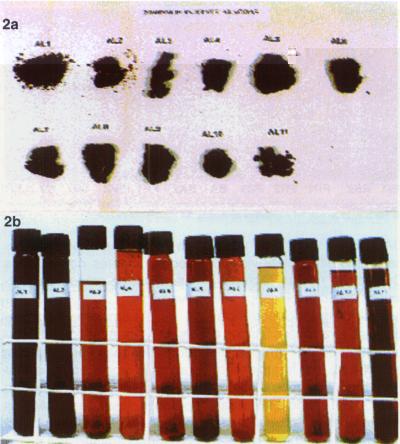
Figura 2. Amostras de própolis do Estado de Alagoas (2a - própolis bruta e 2b - EEP). Amostras de própolis alagoana AL1 a AL11 (da esquerda para a direita).
A separação de compostos químicos de diferentes países, por cromatografia em papel, em camada delgada, ou ainda, em coluna aberta e, a análise pro cromatografia gasosa, líquida de alta eficiência, em camada delgada, bem como técnicas de identificação, tais como espectrometria de massas, espectrografia de infra-vermelho e ressonância magnética nuclear, podem ser utilizadas para se avaliar a composição química destas própolis (Maciejewicz, 2001).
Dado à diferença na composição química das amostras de própolis coletadas na Mata Atlântica alagoana, pôde-se notar uma grande diferença não somente na coloração dos EEP, mas também nos espectros de absorção máxima (Figura 3), e nos perfis cromatográficos em CCDAE-FR (Figura 4). Esta diferença nos espectros na região UV-visível dos EEP é devido, portanto, à variação química em cada amostra de própolis coletada na região de Mata Atlântica. É compreensível entender esta grande diferença nas amostras de própolis coletadas em uma mesma região do litoral alagoano. Aquela região de coleta possui uma grande variedade de micro-ecossistemas, como de mata e de mangue. Logo, a presença de diferentes espécies é grande. Coimbra-Filho (1998) relatou que o Brasil possui uma diversidade biológica distribuída em quatro biomas: floresta amazônica, Mata Atlântica, Cerrado e a Caatinga, e que cada um destes biomas é composto por inúmeros ecossistemas envolvendo comunidades complexas e dinâmicas. A complexidade da Mata Atlântica, a qual é uma dos biomas mais ricos do mundo, mantendo ainda uma razoável diversidade após cinco séculos de devastação, mesmo que a área seja 1% de sua extensão original. Logo, esta diversidade de ecossistemas pode refletir na composição química de produtos como as própolis coletadas por abelhas.
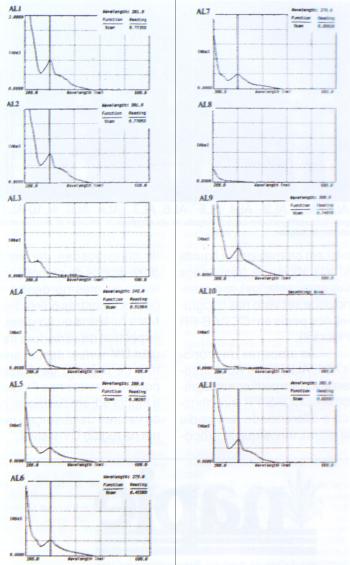
Figura 3. Espectros de absorção máxima na região UV-visível (200-600 nm) dos EEP do Estado de Alagoas.
Na Figura 4 são mostrados, em destaque, os espectros de amostras de própolis da região de Mata Atlântica alagoana em cromatografia de camada delgada que apresentaram forte coloração avermelhada. Estudos sobre as atividades biológicas das onze amostras de própolis, têm mostrado que, principalmente, as amostras AL1, AL2, AL9 e AL11, possuem considerável atividade antimicrobiana contra Staphylococcus aureus coagulase positiva. Estas amostras têm apresentado uma composição química similar em cromatografia líquida de alta eficiência (resultados não apresentados), e o mesmo pode ser visto nas fotografias dos perfis em CCDAE-FR (Figura 4).
Figura 4. Cromatograma em camada delgada de alta eficiência de amostras de própolis de Mata Atlântica de Alagoas..
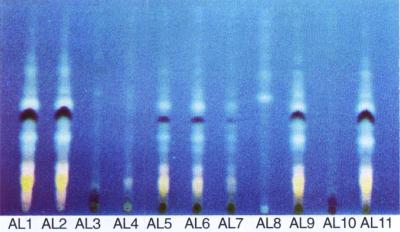
As amostras de própolis AL1, AL2, AL9 e AL11 apresentaram um perfil cromatográfico em CCDAE-FR característico e diferenciado dos perfis de outras amostras de própolis classificadas dentro dos doze grupos de própolis brasileira, ou mesmo dentro das outras amostras coletadas na Mata Atlântica de Alagoas. Os espectros de varredura na região UV-visísel destas amostras de própolis de Alagoas, podem ser visto nas Figura 5a a Figura 5d, em destaque, com os valores de absorção máxima na região UV-visível.
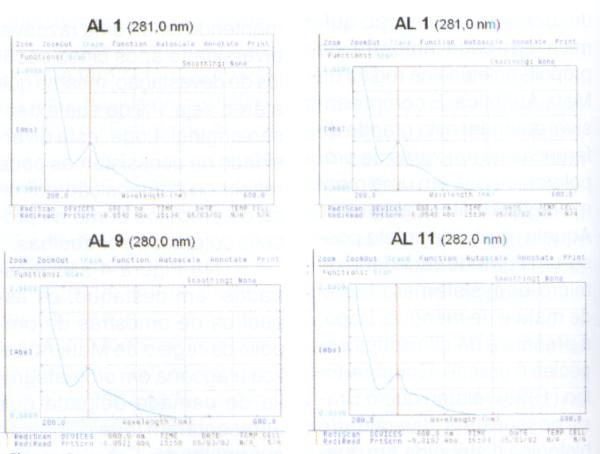
Figura 5. Espectro absorção de amostras de própolis de Alagoas.
Basicamente, todas as amostras apresentaram valores de absorção máxima em torno de 281,0 nm, com perfis de absorção semelhantes entre 200 e 600 nm.
4. CONCLUSÃO
As análises por cromatografia em camada delgada de alta eficiência e espectrofotometria UV-visível, demonstraram uma grande diversidade na composição química nas onze amostras de própolis coletadas na Região Atlântica do Estado de Alagoas, no entanto, quatro destas amostras apresentaram grande semelhança em suas características físico-químicas.
AGRADECIMENTOS
Os autores agradecem a colaboração da Sra. Rúbia Solange Soares Barbalho da INCUBAPEQ (SEBRAE-AL) foi colaboração para com este trabalho de pesquisa.
ACKERMANN, T. Fast chromatography study of propolis crudes. Food Chemistry, 42(2): 135-138, 1991.
AGA, H.; SHIBUYA, T.; SUGIMOTO, K.; NAKAJIMA, Sh. Isolation and identification of antimicrobial compounds in Brazilian propolis. Biosci. Biotech. Biochem. 58:945-946, 1993.
AOKI, M. A. Y.; PASTORE, G. M.; PARK, Y. K. Microbial transformation of sucrose and glucose to erythritol. Biotechnology Letters, 15(4): 383-388, 1993.
ARONSON, N. N.; DAVIDSON, E. A. Lypossomal hyaluronidase from rat liver. Journal of Biology Chemistry, 242: 437-440, 1967.
BANKOVA, V.; BOUDOUROVA-KRASTEVA, G.; SFORCIN, J. M.; FRETE, X.; KUJUMGIEV, A.; MAIMONI-RODELLA, R. POPOV, S. Phytochemical evidence for the origin of Brazilian propolis from São Paulo state. Z. Naturforsch. C, 54: 401-405, 1999.
BANKOVA, V.; CHRISTOV, R.; KUJUMGIEV, A.; MARCUCCI, M. C.; POPOV, S. Chemical composition and antibacterial activity of brazilian propolis. Z. Naturforsch., 50: 167:172, 1995.
BANKOVA, V.; CHRISTOV, R.; STOEV, G.; POPOV, J. Determination of phenolic from propolis by capillary gas chromatography. Journal of Chromatography, 607(1): 150-153, 1992.
BANKOVA, V.; POPOV, S.; MAREKOV, N. L. Isopentenyl cinnamates from poplar buds and propolis. Phytochemistry, 28(3): 871-873, 1989.
BIANCHINI, L.; BEDENDO, I. P. Efeito antibiótico da própolis sobre bactérias fitopatogênicas. Scientia Agricola, 55(1): 149-152, 1998.
BLAIR, J. E.; BORMAN, E. K.; BYNOE, E. T.; UPDYKE, E. L.; WILLIAMS, R. E. O. Hospital acquired staphylococcal disease, recommended procedures for laboratory investigation, Atlanta, GA., United States, Department of Health, Education and Welfare, Public Health Service. 1958.
BONVEHI, J. S.; COLL, F. V.; JORDÁ, R. E. The composition, active components and bacteriostatic activity of propolis in dietetics. Journal of the American Oil Chemists Society, 71(5): 529-532, 1994.
BURDOCK, G. A. Review of the biological properties and toxicity of bee propolis. Food and Chemical Toxicology, 36(4): 347-363, 1998.
CHEN, D. F.; ZHANG, S. X.; CHEN, K.; ZHOU, B. N.; WANG, P.; COSENTINO, L. M.; LEE, K. H. Two new lignans, interiotherins A and B, as anti-HIV principles from Kadsura interior. Journal of Natural Products, 59(11): 1066-1068, 1996.
GHISALBERTI, E. L. Própolis: a review. Bee World, 60(2): 59-84, 1979.
HAMMERSCHMIDT, P. A.; PRATT, D. E. Phenolic antioxidants of dried soybeans. Journal of Food Science, 43(2): 556-559, 1978.
JOHNSON, K. S.; EISCHEN, F. A.; GIANNASI, D. E. Chemical-compositing of North-American bee propolis and biological-activity towards larvae of greater wax moth (Lepidoptera, Pyralidae). Journal of Chemical Ecology, 20(7): 1783-1791, 1994.
KHAYYAL, M. T.; ELGHAZALY, M. A.; ELKHATIB, A. S. Mechanisms involved in the antiinflammatory effect of propolis extract. Drugs under Experimental and Clinical Research, 19(5): 197-203, 1993.
KOO, H.; GOMES, B. P. F. A., ROSALEN, P. L.; AMBROSANO, G. M. B.; PARK, Y. K.; CURY, J. A. In vitro antimicrobial activity of propolis and Arnica Montana against oral pathogens. Archives of Oral Biology, 45(2): 141-148, 2000a.
KOO, H.; ROSALEN, P. L.; CURY, J. A.; AMBROSANO, G. M. B.; MURATA, R. M.; YATSUDA, R.; IKEGAKI, M.; ALENCAR, S. M.; PARK, Y. K. Effect of a new variety of Apis mellifera propolis on mutants Streptococci. Current Microbiology, 41: (3) 192-196, 2000b.
KOO, H.; ROSALEN, P. L.; CURY, J. A.; PARK, Y. K.; IKEGAKI, M.; SATTLER, A. Effect of Apis mellifera propolis from two brazilian regions on caries development in desalivated rats. Caries Research, 33(5): 393-400, 1999.
KOO, H.; SMITH, A. M. V.; BOWEN, W. H.; ROSALEN, P. L.; CURY, J. A.; PARK, Y. K. Effects of Apis mellifera propolis on the activities of Streptococcal glucosyltransferases in solution and adsorbed onto saliva-coated hydroxyapatite. Caries Research, 34: (5) 418-426, 2000c.
KOO, M. H.; PARK, Y. K. Investigação do teor de flavonóides totais da própolis de Apis mellifera do Brasil. Revista Brasileira de Apicultura, 6(2): 8-11, 1996.
KOO, M. H.; PARK, Y. K. Investigation of flavonoid aglycones in propolis collected by two different varieties of bees in the same region. Bioscience, Biotechnology and Biochemistry, 61(2): 367-369, 1997.
KUJUMGIEV, A.; TSVETKOVA, I.; SERKEDJIEVA, Y.; BANKOVA, V.; CHRISTOV, R.; POPOV, S. Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. Journal of Ethnopharmacology, 64(3): 235-240, 1999.
MACIEJEWICZ, W. Isolation of flavonoid aglycones from propolis by a column chromatography method and their identification by GC-MS and TLC methods. Journal of Liquid Chromatography and Related Technologies, 24(8): 1171-1179, 2001.
MARCUCCI, M. C. Propriedades biológicas e terapêuticas dos constituintes químicos da própolis. Química Nova, 19(5): 529-536, 1996.
MARCUCCI, M.C. Propolis: Chemical composition, biological properties and therapeutic activity. Apidologie, 26: 83-99, 1995.
MIYATAKA, H.; NISHIKI, M.; MATSUMOTO, H.L FUJIMOTO, T.; MATSUKA, M.L; SATOH, T. Evaluation of propolis. I: Evaluation of Brazilian and Chinese propolis by enzymatic and physico-chemical methods. Biological and Pharmaceutical Bulletin, 20(5): 496-501, 1997.
PARK, Y.K.; ALENCAR, S.M.; AGUIAR, C.L. Botanical origin and chemical composition of Brazilian propolis. Journal of Agricultural and Food Chemistry, 50: 2502-2506, 2002.
PARK, Y. K.; IKEGAKI, M.; ALENCAR, S. M. Classification of Brazilian propolis by both physicochemical methods and biological activity. Mensagem Doce, 58: 2-7, 2000.
PARK, Y. K.; IKEGAKI, M.; ABREU, J. A. S.; ALCICI, N. M. F. Estudo da preparação dos extratos de própolis e suas preparações. Ciência e Tecnologia de Alimentos, 18(3): 313-318, 1998a.
PARK, Y. K.; KOO, M. H.; IKEGAKI, M.; CURY, J. A.; ROSALEN, P. L. Effects of propolis on Streptococcus mutants, Actinomyces naeslundii and Staphylococcus aureus. Revista de Microbiologia, 29: 143-148, 1998b.
PARK, Y. K.; KOO, M. H.; IKEGAKI, M.; CURY, J. A.; ROSALEN, P. L.; ABREU, J. A. S. Antimicrobial activity of propolis on oral microorganisms. Current Microbiology, 36(1): 24-28, 1998c.
PARK, J. B.; YOOK, C.; PARK, Y. K. Production of erythritol by newly isolated osmophilic Trichosporon sp. Starch/Stärke, 50(2-3):120-123, 1998d.
PARK, J. B.; SEO, B. C.; KIM, J. R.; PARK, Y. K. Production of erythritol in fed-batch cultures of Trichosporon sp. Journal of Fermentation and Bioengineering, 86(6): 577-580, 1998e.
PARK, Y. K.; IKEGAKI, M. Preparation of water and ethanolic extracts of propolis and evaluation of the preparations. Bioscience, Biotechnology and Biochemistry, 62(11): 2230-2232, 1998.
PARK, Y. K.; KOO, M. H.; IKEGAKI, M.; CONTADO, J. L. Comparision of the flavonoid aglycone contents of Apis mellifera propolis from various regions of Brazil. Arquivos de Biologia e Tecnologia, 40(1): 97-106, 1997.
PARK, Y. K.; KOO, M. H.; OLIVEIRA, I. M. A. Biochemical characteristics of osmophilic yeasts isolated from pollens and honey. Bioscience, Biotechnology and Biochemistry, 60(11): 1872-1873, 1996.
PARK, Y. K.; KOO, M. H.; SATO, H. H.; CONTADO, J. L. Estudo de alguns componentes da própolis coletada por Apis mellifera no Brasil. Arquivos de Biologia e Tecnologia, 38(4): 1253-1259, 1995.
PRATT, D. E.; BIRAC, P. M. Source of antioxidant activity of soybeans and soy products. Journal of Food Science, 44(6): 1720-1722, 1979.
PRATT, D. E.; WATTS, B. M. The antioxidant activity of vegetable extracts. I: Flavone aglycones. Journal of Food Science, 29: 27-31, 1964.
REISSING, J. L.; STROMINGER, J. L.; LELOIR, L. F. A modified colorimetric method for the estimation of N-acetylamino sugars. Journal of Biology Chemistry, 217: 959-966, 1955.
RUBINSTEIN, L. V.; SHOEMAKER, R. H.; PAUL, K. D.; SIMON, R. M.; TOSINI, S.; SKEHAN, P.; SCUDIERO, D. A.; MONKS, A.; BOYD, M. R. Journal of Natural Cancer Institute, 82: 1113-1118, 1990.
SABATIER, S.; AMIOT, M. J.; TACCHINI, M.; AUBERT, S. Identification of flavonoids in sunflower honey. Journal of Food Science, 57(3): 773-777, 1992.
TOMAS-BARBERAN, F. A.; GARCÍA-VIGUERA, C.; VIT-OLIVIER, P.; FERRERES, F.; TOMÁS-LORENTE, F. Phytochemical evidence for the botanical origin of tropical propolis from venezuela. Phytochemistry, 34(1):191-196, 1993.