Muitas das terapias milenares de civilizações antigas, utilizaram os produtos das abelhas como valiosos recursos terapêuticos e/ou conservativos. As histórias das medicinas das civilizações Tibetana, Egípcia e também a Greco-Romana são muito ricas, todas contendo em seus escritos antigos, centenas de receitas onde entram principalmente mel, própolis, larvas de abelhas e às vezes as próprias abelhas, para curar ou prevenir enfermidades. Merece destaque a Bíblia Sagrada, oriunda da Civilização Hebraica que em alguns textos enaltece ao mesmo tempo em que enobrece as propriedades alimentícias e medicinais do mel. Outro texto refere-se à própolis que era conhecida como "O bálsamo de Gileade", era utilizada para curar feridas e atingia altos preços no mercado daquela época.
A própolis é uma substância resinosa coletada pelas abelhas de diversas partes da planta como broto, botões florais e exsudatos resinosos. Sua composição química é bastante complexa e variada, estando intimamente relacionada com a ecologia da flora de cada região visitada pelas abelhas. De modo geral contém 50-60% de resinas e bálsamos, 30-40% de ceras, 5-10% de óleos essenciais, 5% de grãos de pólen, além de microelementos como alumínio, cálcio, estrôncio, ferro, cobre, manganês, e pequenas quantidades de vitaminas B1, B2, B6, C e E (Ghisalberti, 1979). A própolis é conhecida, principalmente, por suas propriedades antimicrobiana, antioxidante, antiinflamatória, imunomodulatória, hipotensiva, cicatrizante, anestésica, anticâncer, anti-HIV e anticariogênica (Ghisalberti, 1979; Park et al., 1998; Park et al., 2000). A presença de compostos fenólicos, principalmente os flavonóides, explicam em parte a grande diversidade de propriedades biológicas relatadas na literatura (Park et al., 1995; Banskota et al., 1998). Os flavonóides são compostos fenólicos de baixo peso molecular que têm como base um núcleo flavana, constituído de 15 carbonos dispostos numa configuração C6-C3-C6. Segundo Cook & Samman (1996), a atividade bioquímica dos flavonóides e seus metabólitos depende da estrutura química e orientação relativa das várias partes da molécula.
Em adição, a própolis também tem sido considerada como a principal fonte de compostos fenólicos presentes no mel, e isto tem sugerido que a origem geográfica do mel pode ser determinada a partir do perfil fenólico (Ferreres et al., 1992). Apesar dos carboidratos encontrados no mel serem objetos de diversas revisões (Siddiqui, 1970; White, 1975, 1978; Doner, 1977), outros componentes presentes não foram extensivamente estudados, como por exemplo os compostos fenólicos. Ferreres et al., (1991) e Amiot et al. (1989), mostraram claramente a presença de flavonóides em mel. Entre os flavonóides presentes no mel, a flavanona pinocembrina tem sido relatada e estudada por sua atividade antibacteriana (Berahia et al.,1993). Outros estudos também demonstraram a presença dos flavonóides pinobanksina (Ribeiro-campos et al., 1990), galangina e crisina (Sabatier et al., 1992), kanferol (Ferreres et al., 1998) e ácido benzóico e cinâmico (Weston et al., 1999). Segundo Sabatier et al. (1988), Amiot et al. (1989), Ferreres et al. (1998), Martos et al. (2000a) e Tomás-Barberán et al. (2001) a análise de flavonóides e outros compostos fenólicos pode ser utilizada para a determinação da origem botânica e autenticidade de cada tipo de mel.
Dessa forma a determinação da origem
geográfica e, principalmente, a origem botânica, aliada a
composição química, se faz importante em um controle
de qualidade e até mesmo em uma padronização do mel
e da própolis brasileira para uma efetiva aplicação
terapêutica. Este trabalho apresenta um estudo da composição
química de méis e própolis provenientes de diferentes
regiões do Brasil, bem como a avaliação detalhada
de algumas amostras de méis uniflorais da região sudeste
do Brasil.
2- MATERIAL E MÉTODOS
As amostras de própolis e méis foram coletadas em apiários dos Estados da Bahia (BA8, BA11 e BA12), Pernambuco (PE5), Rio Grande do Sul (BG1) e São Paulo (SE1, SE4, SE5), no período de novembro de 1998 a dezembro de 2000. As amostras foram coletadas diretamente das colméias através da retirada de pedaços de favos, acondicionadas e armazenadas em frascos de vidro limpos, a 5 ºC. Na região sudeste do Brasil também foram realizadas coletas de méis uniflorais de laranja (Citrus aurantium) (SE1), eucalipto (Eucalyptus sp.) (SE4), alecrim do campo (Baccharis dracunculifolia) (SE5), assa-peixe (Vernonia polyanthes) (SE17), rubim (Leonurus sibiricus) (SE18) e capixingui (Croton floribundus) (SE19), juntamente com as amostras de própolis das respectivas colméias.
Os extratos etanólicos de própolis (EEP) foram preparados de acordo com o método descrito por Alencar et al. (2001) e Park et al. (2000), enquanto que os extrato metanólicos de méis (EMM) foram obtidos de acordo com o método descrito por Ferreres et al. (1991).
A cromatografia em camada delgada de alta eficiência dos extratos alcoólicos foi feita de acordo com os métodos descritos por Park et al. (1997) e Park et al. (2000), onde 3 m L dos extratos etanólicos de méis (EEP) e 5 m L dos extratos metanólicos de méis (EMM) foram aplicados em placas RP 18 F254 S (Merck Co.). Utilizou-se como sistema solvente etanol:água destilada (55:45, v/v). As placas desenvolvidas foram observadas sob luz ultravioleta (254 e 366 nm).
As análises por cromatografia líquida de alta eficiência em fase reversa (CLAE) dos EMM foram feitas de acordo com o método modificado de Park et al. (1997) e KOO et al. (2000), onde 20 m l do extrato foram injetados em cromatógrafo líquido acoplado a um detector de arranjo de fotodiodos a 254 nm e uma coluna de fase reversa YMC PACK ODS (250 x 4,6 mm). A fase móvel utilizada foi água/ácido acético (19:1, v/v) (solvente A) e metanol (solvente B), com fluxo constante de 1 ml/min. O gradiente iniciou com 30% do solvente B até 40% de B em 15 minutos, 50% de B em 30 minutos, 60% de B em 45 minutos, 75% de B em 65 minutos, 75% de B em 85 minutos, 90% de B em 95 minutos e 30% de B em 105 minutos. A coluna foi mantida a uma temperatura constante de 35oC e os cromatogramas foram processados utilizando "software" específico. Os compostos foram identificados pelo espectro de absorção na região ultravioleta, utilizando os recursos do detector de arranjo de fotodiodos (SPD-M10A, Shimadzu Co.), pela comparação do tempo de retenção e co-cromatografia de padrões. Foram utilizados padrões autênticos de flavonóides e ácidos fenólicos (Extrasynthese Co.). Adicionalmente, pinobanksina, pinobanksina-3-acetato e o éster do ácido dimetil dialil caféico foram gentilmente cedidos pelo Dr. Eckhard Wollenweber, do Intitut fur Botanik der Technischen Hochschule, Alemanha.
As análises por CG-EM foram feitas pela adição
de 1 mL de uma solução etérea de diazometano (CH2N2)
para a metilação de alíquotas de 400 m
l dos extratos metanólicos de méis. As amostras permaneceram
em banho de gelo por 4 horas para a completa metilação. Após
este tratamento, adicionaram-se 300 m l de diclorometano
(CH2Cl2) e filtraram-se as amostras. As amostras
foram analisadas em cromatógrafo gasoso CG 17A (Shimadzu Co.) acoplado
a um espectrômetro de massas QP 5000 (Shimadzu Co.) equipado com
uma coluna capilar CBP5 30 m x 0,25 mm e um dectetor operando no modo scanning
(m/z 40-400). A programação de temperatura foi 50ºC
(0,3 min) a 285ºC (15 min), com um incremento de 6ºC/min. As
amostras (0,6 m l) foram injetadas por auto-injetor
AOC-17, com injeção splitless. A integração
foi feita através do software específico do equipamento (QP5000
software). Flavonóides e ácidos fenólicos presentes
foram identificados por comparação com os dados obtidos do
CG-EM (tempo de retenção e fragmentação iônica)
de padrões autênticos metilados e eluídos nas mesmas
condições. Outros compostos foram identificados por comparação
com os dados do espectro de massas da biblioteca do equipamento (Willey139-Shimadzu).
3-RESULTADOS E DISCUSSÃO
Cromatografia em camada delgada de alta eficiência em fase reversa (CCDAE-FR) dos EEP e EMM
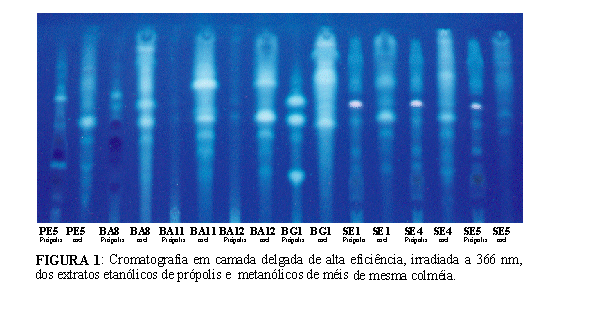
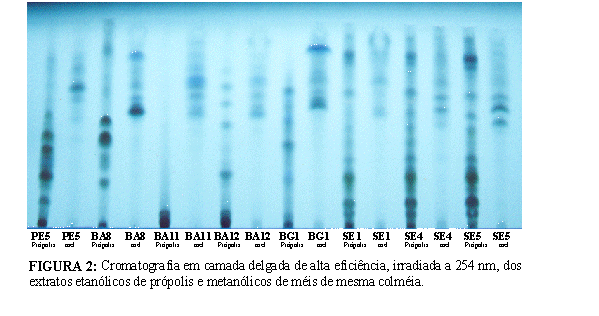
Os extratos alcoólicos de própolis e méis foram analisados por cromatografia em camada delgada de alta eficiência em fase reversa, conforme descrito acima. As figuras 1e 2, ilustram os cromatogramas observados a 366 e 254 nm, respectivamente. A cromatografia em camada delgada permitiu uma visualização rápida da intensidade das frações fenólicas existentes em cada amostra de mel e própolis. Por meio desta técnica foi possível verificar uma grande diferença entre os perfis cromatográficos do EMM e do EEP da mesma colméia. De qualquer modo, e diferentemente da própolis, os compostos fenólicos presentes no mel podem ser originados do néctar das flores, da própolis (Tomás-Barberán et al., 1993) e pólen (Ferreres et al., 1993). As Figuras 1 e 2 mostram claramente que apesar das amostras de mel e própolis do sudeste (SE1, SE4 e SE5) terem sido coletadas em localidades de vegetação unifloral de laranja, eucalipto e alecrim do campo, respectivamente, as própolis apresentaram o mesmo perfil cromatográfico do grupo 12 (própolis do Sudeste), conforme classificação publicada anteriormente na revista Mensagem Doce número 58. Estes resultados demonstram que as abelhas utilizaram fontes vegetais diferentes para elaboração do mel e um única fonte vegetal para a produção da própolis.
Cromatografia líquida de alta eficiência em fase reversa (CLAE-FR) dos extratos metanólicos de méis uniflorais da região Sudeste
A CLAE-FR dos extratos metanólicos de méis uniflorais da região sudeste do Brasil foi realizada de acordo conforme descrito acima. Nos estudos realizados por Ferreres et al. (1991) a CLAE permitiu a identificação de 16 flavonóides em amostras de méis. De acordo com Anklam (1998) somente flavonóides agliconas estão presentes em amostras de própolis e mel. Como pode observado na Figura 3 e Tabela 1, os 6 tipos de méis uniflorais analisados mostraram uma composição fenólica bastante distinta. O mel de laranja (SE1) mostrou a presença dos flavonóides hesperetina e apigenina. De fato a flavanona hesperetina foi sugerida como um possível marcador da origem floral deste tipo de mel, pois este flavonóide não foi encontrado em nenhum outro tipo de mel e a hesperidina (forma glicosilada) é encontrada no néctar de laranja (Ferreres et al., 1998). O mel de alecrim do campo (SE5) foi o que apresentou o maior número de flavonóides. Além disso este tipo de mel mostrou um alto teor do flavonóide quercetina (8,1 m g/g de mel) (Tabela 6), o qual deve ser também responsável pela coloração laranja intensa deste mel. Os flavonóides isosakuranetina e kanferide, identificados no mel de alecrim do campo, também foram comuns nas própolis do grupo 12 (própolis do sudeste), as quais têm a sua origem botânica nesta espécie vegetal. Contudo, os flavonóides quercetina e crisina não estiveram presentes nas própolis do grupo 12. Estes compostos fenólicos devem ser provavelmente oriundos do néctar das flores do alecrim. É notável que os flavonóides presentes no mel sejam exclusivamente agliconas e a maioria deles sejam flavonóides metilados ou outros compostos lipofílicos. Estes não são detectados no pólen, mas são comuns em exudatos de plantas e resinas (Wollenweber & Dietz, 1981). Isto significa que os flavonóides agliconas do mel podem ser parcialmente oriundos dos flavonóides contidos no pólen, resultantes da hidrólise pelas enzimas presentes na saliva das abelhas. Desta forma há a necessidade de mais estudos para se verificar a existência dos flavonóides, principalmente a quercetina, no néctar do alecrim do campo. Este parâmetro poderá funcionar como um marcador químico da origem botânica deste tipo de mel.
O mel de eucalipto mostrou a presença do flavonóide kanferol, o qual também foi encontrado em méis uniflorais de eucalipto da Austrália por Martos et al., 2000b. Estes autores constataram que dependendo da espécie de eucalipto há variação na composição dos flavonóides presentes. A apigenina foi identificada em pequena quantidade nas amostras de méis de laranja e rubim (Tabela 6). Gil et al. (1995) também encontraram a presença deste flavonóide em pequenas concentrações (0,1 a 1,0 m g/g de mel) em amostras de mel de Rosmarinus officinalis L. Da mesma forma Ferreres et al. (1993) demonstraram que, em méis de laranja da Espanha, a ocorrência de apigenina representava uma pequena porcentagem em relação aos demais flavonóides presentes. Não foi identificado nenhum flavonóide nos méis de assa-peixe e capixingui. Entretanto flavonóides encontrados em outros tipos de mel, como por exemplo luteolina, genkwanina, 8-metoxikanferol, pinocembrina 7-metil éter e miricetina 3,7,4’, 7’ metil éter (Siess et al., 1996) não foram utilizados como padrões nestas análises de CLAE.