Própolis é um material resinoso de constituição complexa formado por secreção de abelhas e exsudatos, ceras e outras substâncias que elas coletam de plantas. Devido à grande proteção que ela dá às colmeias contra o ataque e proliferação de microorganismos, desde a antiguidade a humanidade passou a utilizá-la como medicamento1. Acredita-se que suas propriedades curativas se devam fundamentalmente aos compostos fenólicos existentes em sua composição, sobretudo aos flavonóides1.
A própolis do Brasil tem uma ótima aceitação no mercado internacional devido às suas propriedades terapêuticas2-4. Este fato despertou a curiosidade de cientistas brasileiros e de outros países2-6. Os resultados obtidos até o momento mostram que a própolis brasileira originada de São Paulo e Paraná tem menos flavonóides que a própolis européia, embora ambas possuam as mesmas famílias de constituintes6. No entanto, valendo-se da cromatografia líquida de alta eficiência (CLAE), Maia e colaboradores encontraram um maior conteúdo de flavonóides do que aquele obtido pela análise tradicional (espectroscopia no UV) para a própolis da região de Belo Horizonte – MG7. Recentemente, Park e colaboradores mostraram que uma própolis baiana foi altamente efetiva contra estreptococos embora não contivesse flavonóides nem derivados do ácido cinâmico8.
O presente trabalho pretende dar uma contribuição a esse estudo e traz os resultados da análise de uma amostra de própolis da região do cerrado do Triângulo Mineiro. Nesta primeira parte são apresentados os extrativos obtidos com metanol que se solubilizaram em acetato de etila.
Parte experimental
Amostra de própolis
A amostra foi fornecida pelo Apiário Santa Rita. Sua coleta foi realizada em 24 de fevereiro de 1999, em colmeias situadas num pasto de Brachiarea decumbens ao lado de um reflorestamento de Eucalyptus urophilla e vegetação típica do cerrado, a 40 Km a oeste de Uberlândia. O material foi retirado mais do interior do que da entrada das caixas para evitar impurezas e grande umidade. Ele apresentava uma coloração amarronzada, textura elástica e umidade de 5,07 %.
Obtenção dos extratos e cromatografia de coluna
A obtenção dos extratos e separação das diversas frações por cromatografia em coluna foi realizada conforme procedimento descrito por Banskota5. (Figura 1). 24,0 g de própolis foram tratados com 1 L de água destilada, em um béquer com agitação, por duas horas a 80 ° C; filtrou-se e repetiu-se a extração uma vez.
A porção insolúvel em água (resíduo1) foi, em seguida, extraída com metanol (grau cromatográfico, 2 litros por duas horas, duas vezes em refluxo), resultando-se o extrato metanólico após filtração. A parte insolúvel em metanol (resíduo 2) foi tratada, então, com clorofórmio (grau cromatográfico, 2 litros, temperatura ambiente, por duas vezes), obtendo-se o extrato clorofórmio após filtração e o resíduo final.
O extrato metanólico foi seco em um rotaevaporador, a 40 oC, e fracionado em duas partes; uma solúvel em acetato de etila (grau cromatográfico) e a outra insolúvel em acetato de etila. A fração solúvel em acetato de etila da própolis brasileira apresentou os melhores resultados em ensaios citotóxicos segundo Banskota e colaboradores5. Por isto, este trabalho dá ênfase à análise dessa fração. Para tanto ela foi separada em uma coluna (70 x 10 cm) de sílica gel em clorofórmio com 2 L dos seguintes eluentes: 5 % MeOH:CHCl3, 5 % MeOH: CHCl3, 5 % MeOH:CHCl3, 10 % MeOH:CHCl3, 10 % MeOH:CHCl3, 20 % MeOH:CHCl3, 20 % MeOH:CHCl3, 20 % MeOH:CHCl3, 30 % MeOH:CHCl3, 40% MeOH:CHCl3, 50 % MeOH:CHCl3, 60 % MeOH:CHCl3 e 100 % MeOH. Para efeitos de comparação, se apresentará também a análise do extrato clorofórmio, obtido após a sequência de eluições acima.
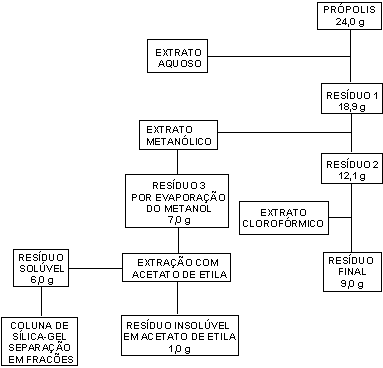
Figura 1 – Rota extrativa utilizada no trabalho5
Metilação e sililação
O solvente de uma alíquota de cada fração cromatográfica foi evaporado em um rotaevaporador a 40 oC, e a aproximadamente 10 mg do resíduo seco foram adicionadas três gotas do reagente de metilação (hidróxido de tetrametilamônio); para a sililação foram adicionadas três gotas de piridina e cinco gotas do reagente de sililação (BSTFA); deixou-se em repouso por cinco minutos e injetou-se no cromatógrafo (1 m L).
Cromatografia gasosa acoplada à espectrometria de massas (CG-EM)
A CG-EM foi realizada num aparelho Shimadzu – QP 5000. As condições operacionais usadas na cromatografia foram: coluna DB5 de 30 m, 0,25 m de espessura do revestimento interno e 0,25 mm d.i., programa de temperatura de 100 oC – 285 oC (8 oC/min); 285 oC (47 min); temperaturas do injetor e detetor de 250 oC e 270 oC, respectivamenteA espectrometria de massas foi feita com energia de impacto de 70 eV e foram coletados fragmentos de 45 a 650 Da. Para a identificação dos compostos foram usados a biblioteca de espectros de massas acoplada ao aparelho (Wiley 275.000) e índices de Kovat
Resultados
O acetato de etila dissolveu aproximadamente 86 % do resíduo extraído pelo metanol. A cromatografia em coluna deste extrato (vide Figura 1) forneceu treze frações com diferentes concentrações de metanol em clorofórmio. A Figura 2 apresenta o cromatograma gasoso da primeira fração a 5 % MeOH:CHCl3, após evaporação dos solventes e metilação. A maior parte dos componentes mostrados no cromatograma está constituída por ácidos carboxílicos aromáticos e alifáticos: benzóico (tempo de retenção, tr, = 7,3 min), heptanóico ( tr = 11,1 min), trans-cinâmico (tr = 12,5 min), palmítico (tr = 20,6 min), elaídico (tr = 23,0 min) e eicosanóico (tr = 35,7 min). Além deles foi identificada a guaiacilacetona (tr = 15,1 min). Ficou o composto de tr = 23,2 min (que está presente em pequena concentração) sem poder ser identificado. Os constituintes que aparecem a 4,1 e 5,4 min são contaminações. É interessante observar que esta primeira fração orgânica não traz componentes voláteis comuns em própolis9. Seguramente estes componentes que aparecem em pequenas concentrações foram arrastados com a evaporação da grande quantidade de solvente utilizada no presente trabalho.
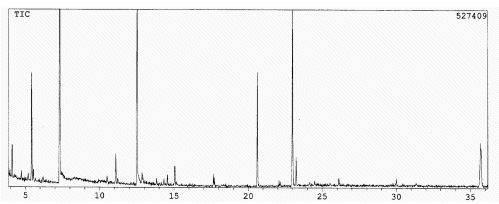
Figura 2. Cromatograma gasoso da primeira fração extraída
com 5 % MeOH:CHCl3
A Figura 3 apresenta o cromatograma da segunda fração com 5 % MeOH:CHCl3. O ácido trans-cinâmico está em maior concentração que o ácido benzóico; os ácidos palmítico e elaídico aparecem em pequena concentração e o eicosanóico nem aparece. Novos componentes surgem com destaque: álcool benzílico a tr = 6,2 min e benzoato de benzila (tr = 19,0 min). O cinamato de benzila (tr = 23,5 min), o álcool cinamílico (tr = 11,1 min) e três alcanos (tr = 25,7; 29,5 e 34,8 min, respectivamente) marcam presença com intensidades média e baixas. Desta feita ficaram sem ser identificados dois componentes de pequena e média concentração, a tr = 4,8 e 11,2 min, respectivamente, e outros em pequena concentração, a tr = 4,2; 4,6; 5,5; 6,3; 8,4; 23,3 e 23,4 min. O contaminante a tr = 5,4 min continua presente em grande concentração.
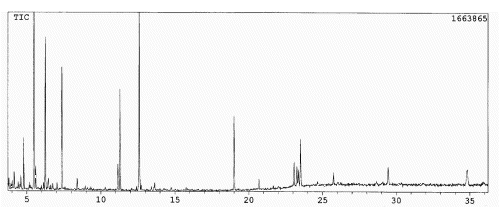
Figura 3. Cromatograma gasoso da segunda fração extraída com 5 % MeOH:CHCl3
A Figura 4 apresenta a terceira fração com 5 % MeOH:CHCl3. Mais uma vez estão presentes de uma maneira expressiva os ácidos benzóico e trans-cinâmico, o álcool benzílico e o ácido elaídico aparecem em pequena concentração. A tr = 11,2; 14,3 e 17,7 min surgem três novos constituintes que não puderam ser identificados. Provavelmente os dois últimos são isômeros porque apresentam espectros de massas muito parecidos que têm pico-base a m/z 131 e outro de baixa intensidade a m/z 147. Isto sugere que são ésteres do ácido cinâmico.
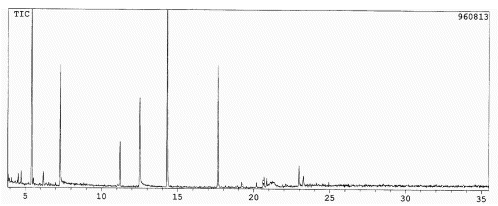
Figura 4. Cromatograma gasoso da terceira fração extraída com 5 % MeOH:CHCl3
As seis frações seguintes, até a de 30 % MeOH:CHCl3 (cromatogramas não mostrados) foram pobres em extrativos, em todas elas apareceram os ácidos benzóico e trans-cinâmico em pequenas concentrações; além deles foram observados, também em baixas concentrações, os ácidos elaídico, heptanóico, palmítico e 12-metil-tetradecanóico. Foram observados também em duas frações, com elevada concentração, a biciclo[2.2.2]-octenona e um outro composto cuja fragmentação se assemelha à de flavonóides, porém, o índice de similaridade dado pela biblioteca de espectro de massas alcançou no máximo 52 %, indicando isto que o flavonóide considerado não consta da biblioteca do aparelho. Na fração de 30 % apareceu, com média intensidade, a 4-metil-4-metoxi-2-pentanona e na de 20 %, igualmente com média intensidade, apareceu uma substância que não pôde ser identificada.
A fração obtida com 40 % MeOH:CHCl3 apresentou-se mais rica em constituintes. O cromatograma de seus extrativos sililados resultou melhor que o correspondente metilado e por isto ele foi utilizado (Figura 5). O ácido benzóico que agora tem um tempo de retenção maior por estar sililado (tr = 9,9 min) continua sendo o componente mais abundante; logo em seguida (tr = 10,1 min) aparece o glicerol, também relativamente abundante; o componente de média intensidade a tr = 8,5 min é o ácido 4-hidroxibutírico e a tr = 15,1 min aparecem simultaneamente a vanilina e o ácido trans-cinâmico; com tr = 21,0 min se situa o hexadecanol e a tr = 24,7 min observa-se o ácido esteárico. Os componentes com tr = 13,2; 22,1; 23,5 e 24,4 min têm fragmentação similar a de flavonóides mas o índice de similaridade apresentado com os espectros dos flavonóides existentes na biblioteca do aparelho é baixo. Finalmente, o composto de tr = 20,1 min não pôde ser identificado e o de tr = 29,9 min é um contaminante.
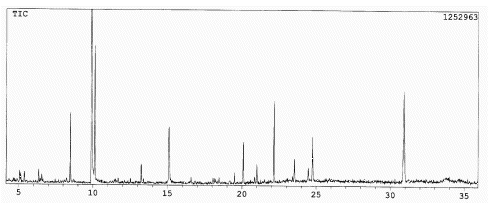
Figura 5. Cromatograma gasoso da fração extraída
com 40 % MeOH:CHCl3 (sililada).
A fração obtida com 50 % MeOH:CHCl3 (cromatograma não mostrado) é pobre em constituintes. Nela estão presentes os ácidos benzóico e trans-cinâmico, glicerol e, em pequena concentração, o ácido lático.
A fração resultante da eluição com 60 % MEOH:CHCl3 apresentou-se mais rica em constituintes. A Figura 6 mostra seu cromatograma. Os principais constituintes são o ácido benzóico e trans-cinâmico (tr = 9,9 e 15,1 min, respectivamente); em menor concentração vêm o etilenoglicol, o glicerol e o ácido 2-ceto-D-glucônico (tr = 5,1, 10,1 e 19,2 min, respectivamente); os ácidos lático, cis-cinâmico e p-cumárico (tr = 6,3, 13,2 e 18,9, respectivamente) e a L(+)-arabinose aparecem em pequenas concentrações; finalmente, os picos a tr = 20,1 e 30,9 min são de ftalatos (contaminantes).
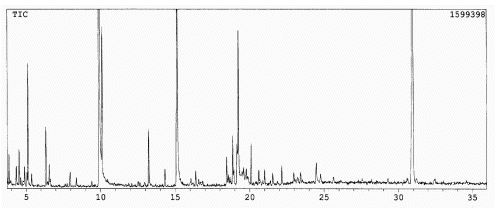
Figura 6. Cromatograma gasoso da fração extraída com 60 % MeOH:CHCl3 (sililada).
O extrato de própolis obtido com 100 % MEOH (cromatograma não mostrado) apresentou somente os ácidos benzóico e trans-cinâmico.
Finalmente, o extrato obtido com clorofórmio, após a extração com metanol (veja Figuras 1 e 7), continha ácidos carboxlicos (destacando-se o elaídico, palmítico e cis-cinâmico, tr = 23,0, 20,7 e 12,6, respectivamente) e alcanos de cadeia longa ( tr > 25 min). O composto de tr = 7,2 min não pôde ser identificado.
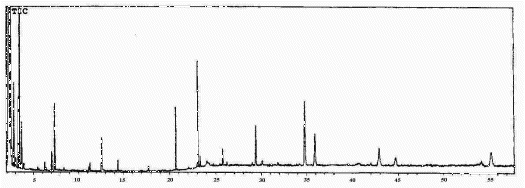
Figura 7. Cromatograma gasoso do extrato clorofórmio (sililado).
Discussão dos resultados e conclusões
Os componentes dos extratos de acetato de etila e clorofórmio estudados no presente trabalho pesaram 9,1 g. Isto corresponde 39,9 % da massa total de própolis tratada inicialmente ( 22,8 g, base seca). A Tabela 2 apresenta todos os componentes identificados nas quatorze frações analisadas. Os ácidos benzóico e trans-cinâmico foram os mais abundantes e mais presentes nas diferentes frações. Em geral os ácidos se destacaram, mas, além desta função, foram detetados também alcanos de cadeia longa, pequenas concentrações de flavonóides (cujos espectros de massas não constavam da biblioteca do aparelho), álcoois, aldeídos, cetonas, açúcares e um éster.