
COMPARAÇÃO DAS CARACTERÍSTICAS FÍSICO-QUÍMICAS DAS PRÓPOLIS PRODUZIDAS NA REGIÃO SUB-TROPICAL DA AMÉRICA DO SUL: EVIDÊNCIA FITOQUÍMICA DE SUA ORIGEM BOTÂNICAYong Kun Park1; Severino Matias de Alencar1; Cláudio Lima de Aguiar1; Adilma R. P. Scamparini1; Mariela González2 & Maria A. A. Molina2.
1- Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas (UNICAMP), Campinas, SP, Brasil;
2- Faculdade de Bioquímica, Química e Farmácia, Universidade Nacional de Tucumán, Tucumán, Argentina
1- INTRODUÇÃO
Praticamente todas as civilizações antigas com as suas terapias milenares conheceram e utilizaram os produtos das abelhas como valiosos recursos na sua medicina. As histórias das medicinas das civilizações Chinesa, Tibetana, Egípcia e também a Greco-Romana são muito ricas, todas contendo em seus escritos antigos, centenas de receitas onde entram principalmente mel, própolis, larvas de abelhas e às vezes as próprias abelhas, para curar ou prevenir enfermidades. Merece destaque a Bíblia Sagrada, oriunda da Civilização Hebraica que em alguns textos enaltece ao mesmo tempo em que enobrece as propriedades alimentícias e medicinais do mel. Outro texto refere-se à própolis que era conhecida como "O bálsamo de Gileade", era utilizada para curar feridas e atingia altos preços no mercado daquela época. A própolis é uma substância resinosa e balsâmica, que possui coloração e consistência diversa, variando de coloração marrom até verde escuro. É coletada por abelhas de diversas partes das plantas como brotos, botões florais e exudados resinosos, sendo transportados para dentro da colméia e modificados pelas abelhas através de suas próprias enzimas (Ghisalberti, 1979). Esta substância é utilizada pelas abelhas na entrada das colméias, fechando frestas para redução da entrada do vento frio e, principalmente, dos inimigos naturais (fungos e bactérias), além de ser utilizada para embalsamar pequenos animais mortos, pelas abelhas e que não puderam ser retirados, evitando assim a putrefação. A própolis também é utilizada como material de construção no interior da colméia, soldando favos, quadros e envernizando o interior dos alvéolos para que a rainha faça a postura.
Em países de clima temperado da Europa e América do Norte, os vegetais produtores de própolis são poucos. O choupo, Populus L., da família Salicaceae é a principal fonte. Ainda pode-se encontrar esta espécie vegetal na Ásia e no norte da África. Entretanto, não é natural dos trópicos. No Brasil, existem diversas espécies vegetais para a retirada de resina. No entanto, poucas foram as espécies identificadas até agora, mas o assa-peixe, aroeira, eucalipto e alecrim são alguns exemplos de vegetais produtores de própolis.
Os efeitos terapêuticos têm sido atribuídos aos diversos compostos fenólicos que compõe a própolis e que estão largamente distribuídos no reino vegetal. Destes, os flavonóides podem ser considerados os principais compostos, encontrando-se ainda, alguns ácidos fenólicos e seus ésteres, aldeídos fenólicos, álcoois e cetonas. Fatores como a ecologia vegetal da região onde a própolis foi coletada (Park et al., 1995; Park et al., 1997) e a variabilidade genética das rainhas (Koo & Park, 1997), também influenciam na composição química da própolis. A investigação da origem vegetal dos diversos tipos de própolis tem sido um dos principais motivos de nossas pesquisas com própolis no Brasil.
O objetivo desse trabalho foi analisar algumas características químicas e biológicas de amostras de própolis oriundas da região sub-tropical da América do Sul. Neste estudo foi incluído a região sul do Brasil (excluindo-se as áreas do nordeste, sudeste e norte da região sul), Argentina e Uruguai.
2-METODOLOGIA
2.1- Determinação das características físico-químicas
Os extratos etanólicos de própolis (EEP) e metanólicos da resina de álamo foram preparados como descrito por Park & Ikegaki (1998). Após a extração, a mistura foi centrifugada e o sobrenadante utilizado para a realização dos diferentes estudos.
Entre as análises realizadas para a classificação dos diferentes tipos de própolis, uma das mais importantes é a cromatografia em camada delgada de alta eficiência (CCDAE) na qual, após o desenvolvimento em sistema de solvente adequado, é possível observar os diferentes perfis da composição química da própolis e, dessa forma, classificá-la em diferentes grupos. Além dessa técnica, foi também utilizada a metodologia onde se determinou o espectro de absorção em luz ultravioleta, na qual, cada tipo de própolis apresenta uma curva de absorção característica nessa faixa de comprimento de onda e a cromatografia líquida de alta eficiência (CLAE) na tentativa de identificar alguns dos compostos existentes na própolis.
Para realização da cromatografia em camada delgada de alta eficiência (CCDAE), alíquotas de 3 m L dos respectivos extratos foram aplicados em cromatoplacas (10 x 10 cm) RP-18 F254-S (Merck Co.). O tempo de desenvolvimento do cromatograma foi de 100 minutos aproximadamente, utilizando como sistema de solvente etanol 95%:água destilada (55:45, v/v). Após o término do desenvolvimento da corrida, as placas foram observadas sob luz ultravioleta nos comprimentos de onda de 254 e 366 nm, utilizando iluminador U.V. Cole Parmer, modelo UVP-UVGL-58.
Para a determinação do espectro de absorção dos extratos etanólicos de própolis, alíquotas de 25 m l do extrato foram diluídas em 30 ml de etanol 95% e o espectro de absorção na região U.V. das amostras foi determinado na faixa de comprimento de onda entre 200 a 600 nm ("U.V. scanning") utilizando espectrofotômetro Beckman DU-70.
A cromatografia líquida de alta eficiência foi realizada utilizando cromatógrafo líquido Shimadzu modelo LC-10 equipado com coluna de fase reversa e acoplado ao detector de arranjo de diiodo. A fase móvel utilizada foi uma mistura de metanol, água e ácido acético em um sistema de gradiente. Para identificação dos compostos foram utilizados padrões autênticos fornecido pela Extrasynthese A.A. Co., França.
2.2- Determinação das propriedades biológicas
Teste da atividade antimicrobiana dos extratos etanólicos de própolis em bactérias patogênicas
Nos discos de papel de filtro Whatman n° 3 (5 x 1mm de diâmetro) foram aplicados 10 m L dos respectivos extratos de própolis e então colocados em dessecador com sílica à temperatura ambiente por 24 horas. Posteriormente, foram mantidos na estufa a 60° C por 2 horas para eliminação de qualquer resíduo etanólico. A análise da atividade antimicrobiana dos extratos de própolis na bactéria gram positiva Staphylococcus aureus coagulase positiva foi realizada de acordo com o método descrito por Blair et al. (1958). Culturas ativas de S. aureus foram inoculadas por espalhamento com "swabs" estéreis em placas de Petri contendo ágar nutriente. Os discos com os extratos foram colocados sobre as placas inoculadas e incubadas a 37oC por 24 horas. A atividade antimicrobiana foi determinada pela formação de halo inibitório ao redor dos discos.
Determinação da atividade antioxidante dos extratos etanólicos de própolis A atividade antioxidante foi determinada pela oxidação acoplada do b -caroteno e do ácido linoléico como descrito nas referências (Hammerschimidt & Pratt, 1978; Pratt & Birac, 1979; Pratt & Watts, 1979). Segundo esse método, a própolis agiria como o agente antioxidante, protegendo o b -caroteno de sofrer oxidação causada pelos radicais formados a partir da oxidação do ácido linoléico.
Determinação da atividade anti-inflamatória dos extratos etanólicos de própolis
A inibição da atividade de hialuronidase foi determinada conforme descrito nas referências (Reissing et al., 1955) e (Aronson & Davidson, 1967). A partir dessa metodologia, a própolis agiria sobre a enzima hialuronidase, inibindo a sua atividade sobre o substrato, conhecido como ácido hialurônico. Essa enzima é responsável por vários processos inflamatório, sendo que, se um determinado composto é capaz de inibir sua atividade, tem grande potencial para ser utilizado como substância
3- RESUSLTADOS E DISCUSSÃO
Análise dos extratos etanólicos de própolis
Foram analisadas ao todo 27 amostras de própolis de diferentes regiões subtropicais da América do Sul, sul do Brasil (6), Argentina (13) e Uruguai (8). De acordo com o artigo anterior, "Classificação das Própolis Brasileiras" publicado nesta mesma revista nº 58, a região sul do Brasil possui, até o momento, 5 tipos distintos de própolis.
Após o processamento e análise das amostras quanto à aparência e coloração dos extratos, o espectro de absorção na região do UV-visível e o perfil da CCDAE (Figura 1) e CLAE (Figura 2), foi possível observar que o perfil da própolis do grupo 3 (Santa Cruz-PR) mostrou ser o mesmo encontrado no Uruguai e Argentina (Buenos Aires e Tucumán), apesar da cromatografia em camada delgada para amostra de Tucumán mostrar uma banda mais escura no início da corrida. Quando observa-se a análise dos flavonóides existentes nessas própolis feita por CLAE (Tabela 1 e Figura 2), pode-se constatar que todas possuem os mesmos flavonóides, variando somente a proporção. Isto pode ser explicado em parte pela variação climática, o que pode causar uma certa oscilação na proporção dos componentes da fonte vegetal primária em cada estação do ano. No caso da amostra brasileira, a coleta foi realizada na estação do inverno. Todos estes resultados sugerem a mesma fonte vegetal para a origem botânica dessas própolis.

|
|
|
|
|
|
| Ácido cumárico |
|
|
|
|
| Ácido ferrúlico |
|
|
|
|
| Pinobanksina |
|
|
|
|
| Kanferol |
|
|
|
|
| Apigenina |
|
|
|
|
| Pinocembrina |
|
|
|
|
| Dimetil dialil ácido caféico |
|
|
|
|
| Pinobanksina 3-acetato |
|
|
|
|
| Crisina |
|
|
|
|
| Galangina |
|
|
|
|
Análise fitoquímica do material vegetal
As amostras brasileiras de própolis e resinas vegetais utilizadas foram coletadas na região sul do Brasil, na divisa dos estados do Paraná e Santa Catarina e Rio Grande do Sul. Nessa região, existem diversas áreas de reflorestamento cultivadas com uma espécie de álamo (Populusalba), que foi trazida da Europa por descendentes alemães, e que dá origem a um tipo de própolis bastante comum em países de clima temperado. O extrato metanólico da resina álamo coletada, foi analisado por cromatografia em camada delgada de alta eficiência (CCDAE) (Figura 3), espectrofotometria na região uv-visível (Figura 3) e cromatografia líquida de alta eficiência (CLAE) (Figura 4) o qual mostrou ser o mesmo da própolis. De acordo com os resultados da cromatografia líquida de alta eficiência, pode-se verificar a mesma composição química da própolis, sendo encontrado pelo menos 25 compostos químicos idênticos (Figura 4). A composição química da própolis (Santa Cruz-PR) e da resina de álamo também foi confirmada utilizando a técnica de espectrometria de massa. Dessa forma, pode-se dizer que todas as amostras analisadas, (Santa Cruz – Brasil; Buenos Aires e Tucumán – Argentina e Uruguai), inclusive a amostra dos Estados Unidos, que são idênticas quimicamente a resina de álamo, têm a sua origem nessa espécie de vegetal.
Atividade antioxidante e antiinflamatório
Os resultados da atividade antioxidante dos extratos etanólicos de própolis estão ilustradas na Figura 5 e, indicam que todos as própolis apresentaram boa atividade antioxidante, acima de 80%, exceto a amostra de Buenos Aires que apresentou atividade um pouco menor que 80%. Apesar disso, todas amostras mostraram uma tendência para um padrão único. Estes dados corroboram com a hipótese dessas própolis possuírem a mesma composição química e, conseqüentemente a mesma origem vegetal. Com relação à atividade antiinflamatória, ou seja, a inibição da enzima hialuronidase, todas as amostras também tenderam a exibir as mesmas porcentagens de inibição da enzima (Figura 6). A exceção foi para a amostra dos Estados Unidos, o que pode ser explicado pelo fato dela ser uma amostra selecionada e comercializada pela sigma, possuindo assim um alto grau de pureza.
Atividade antimicrobiana dos extratos etanólicos de própolis
A atividade antimicrobiana de todos os grupos selecionados foi realizada utilizando o microrganismo patogênico Staphylococcus aureus. Os resultados estão apresentados na Tabela 2. Com relação à atividade sobre Staphylococcus aureus, todas as própolis mostraram atividades inibitórias semelhantes, com exceção para a própolis do Uruguai que inibiu de forma moderda. A resina de álamo inibiu fortemente o crescimento da bactéria Staphylococcus aureus, evidenciando assim que pode ser a fonte de compostos responsáveis pela atividade antimicrobiana neste tipo de própolis.

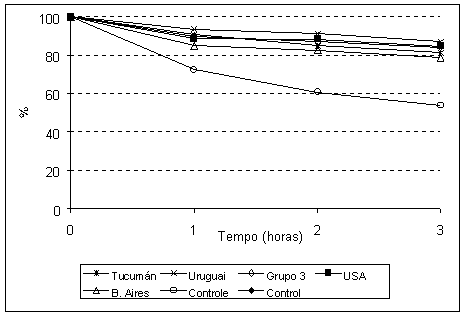
Figura 5: Atividade antioxidante dos extratos etanólicos de própolis
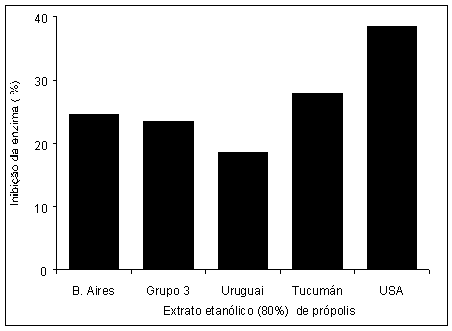
Figura 6: Atividade antiinflamatória dos extratos etanólicos de própolis
Tabela 2: Atividade antimicrobiana dos extratos etanólicos de própolis e metanólicos de álamo sobre o microrganismo Staphylococcus aureus.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4- CONCLUSÕES
De acordo com o nosso trabalho anterior, a região sul do Brasil possui 5 tipos distintos de própolis e um, o tipo grupo 3, é comum nos países sul-americano de clima subtropical (Brasil, Argentina e Uruguai). Isso mostra que a região Sul do Brasil possui uma maior diversidade de tipos de própolis do que os outros países estudados. Entretanto, há a necessidade de maiores estudos para a verificação da existência de outros tipos de própolis nesses países (Uruguai, Argentina e outros), visto que as amostras enviadas para a análise podem não representar todos os perfis de própolis existentes. Foi possível constatar que todas as própolis estudadas mostraram propriedades biológicas semelhantes. Isto é devido ao fato, principalmente, de terem a mesma origem vegetal, ou seja, as abelhas utilizam a resina de álamo (Populus sp.) para a elaboração da própolis.
Dessa forma, deve-se realizar mais pesquisas para a verificar a qualidade desse tipo de própolis e ainda, um maior aprofundamento nos estudos sobre as propriedades biológicas e também a identificação dos eventuais compostos responsáveis por essas propriedades.
Agradecimentos
Agradecemos ao Dr. E. Wollenweber pelo fornecimento de alguns padrões autênticos e pela cooperação nesse trabalho.
5-REFERÊNCIAS BIBLIOGRÁFICAS
ARONSON, N.N.; DAVIDSON, E.A. Lysossomal hyaluronidase from rat liver. J. Biol. Chem., v.242, p.437-440, 1967.
BLAIR, J. E.; BORMAN, E. K.; BYNOE, E. T.; UPDYKE, E. L.; WILLIANS, R. E. O. Hospital acquired satphylococcal disease, recommended procedures for laboratory investigation. Atlanta,G.A: United States Department of Health, education and Welfare, Public Health Service, 1958.
GHISALBERTI, E.L. Propolis; A review. Bee World, v.60, p.59-84, 1979.
HAMMERSCHMIDT, P.A.; PRATT, D.E. Phenolic antioxidants of dried soybeans. J. Food Sci., v.43, p.556-559, 1978.
KOO, M.H.; PARK, Y.K. Investigation of flavonoid aglycones in propolis collected by two different varieties of bees in the same region. Biosci. Biotech. Biochem., v.61, p.367-369, 1997.
PARK, Y.K. & IKEGAKI, M. Preparation of water and ethanolic extracts of propolis and evaluation of the preparation. Biosci. Biotechnol. Biochem., v.62, p.2230-2232, 1998.
PARK, Y.K.; KOO, M.H., SATO, H.H.; CONTADO, J.L. Estudo de alguns componentes da própolis coletada por Apis mellifera no Brasil. Arq. Biol. Tecnol., v.38, p.1253-1259, 1995.
PARK, Y.K; KOO, M.H.; IKEGAKI, M.; CONTADO, J.L. Comparison of the flavonoid aglycone contents of Apis mellifera propolis from various regions of Brazil. Arq. Biol. Tecnol., v.40, p.97-106, 1997.
PRATT, D.E.; BIRAC, P.M. Source of antioxidant activity of soybeans and soy products. J. Food Sci., v.44, p.1720-1722, 1979.
PRATT, D.E.; WATTS, B.M. The antioxidant activity of vegetable extracts. I: Flavone aglycones. J. Food. Sci., v.29, p.27-31, 1964.
REISSING, J.L.; STROMINGER, J.L; LELOIR, L.F. A modified colorimetric method for the estimation of N-acetylamino sugars. J. Biol. Chem., v.217, p.959-966, 1955.