VIDA-DE-PRATELEIRA DO MEL PRODUZIDO EM ÁREA DE CERRADO DO ESTADO DE MINAS GERAIS
RESUMO
Palavras-chave: mel, vida-de-prateleira, crescimento microbiano, teor de umidade, espectro polínico
Shelf life of honey produced in some savanas regions of State of Minas Gerais - Forthy-five honey samples were studied on its microbiological, microscopical and physico-chemical aspects, concerning to the Salmonella sp. detection; molds, yeasts and faecal coliforms counts; and evaluation of pollinic spectra and moisture content, in order to estabilish its shelf life. The honey analysis were carried out during a storage period of two, four, six, eight and twelve months. All samples were kept at room temperature and bottled in glass flasks. The results revealed moisture content ranging from 17,0% to 18,9% in the complete storage period. Salmonella sp. was not detected and faecal coliforms counts was <3.0 NMP/g. The molds and yeasts enumeration ranged from <1 to 40 UFC/g for 43 samples (95.5%) stored during twelve months, and from 102 to 103 UFC/g for only two samples stored during eight and twelve months, respectivelly. The honey produced in some savanas regions of State of Minas Gerais presented a pollinic spectra of Schinnus sp., Vernonia sp. and Eucalyptus sp. In this conditions, the honey analysed, when kept in glass flasks, showed a shelf life for a period evaluated up to twelve months.
Key-words: honey, shelf life, microbial growth, moisture content, pollinic spectra
INTRODUÇÃO
Quando coletado em épocas de seca, aquela
que caracteriza sua safra, e estando os favos em estado de completa
operculação, o mel "in-natura" apresenta atividade
de água que oscila de 0,546 a 0,589 e se enquadra entre os alimentos
com teor de umidade intermediária, situada na faixa de 15,0 a 19,0%,
podendo, conforme climática tropical, atingir teor de até
20,0% de umidade (WHITE, 1976; BONVEHI, 1989; GÓMEZ et alii, 1990;
KRAMER, 1997).
De acordo com as propriedades inerentes ao mel - pH, teor de umidade,
potencial de óxido-redução, aporte nutricional e constituintes
antimicrobianos - baixas contagens e tipo de microrganimos, basicamente,
bolores, leveduras e esporulados, são esperados neste substrato
(SNOWDON & CLIVER, 1996). Através de uma fonte primária
de contaminação na qual se incluem pólen, nectar floral,
poeira, terra e o próprio corpo e trato digestivo de abelhas, este
grupo de microrganismos pode ter acesso ao mel. Em outra forma ou fonte
secundária de contaminação, esta última mais
facilmente controlável, podem ser destacadas, principalmente, as
condições de manipulação no decorrer da coleta,
processamento, envase e armazenagem do produto (SNOWDON & CLIVER, 1996).
Um dos principais problemas que interfere na vida-de-prateleira do mel está vinculado a deterioração pela fermentação que, segundo WHITE JR, (1978), desde há muito, representa perda econômica para países, entre outros, o Canadá. A fermentação do mel é ocasionada pela ação de leveduras osmofílicas, as quais bem se desenvolvem em condições ácidas e não são inibidas pela presença de sacarose. O processo de fermentação implica na quebra de açúcares com produção de álcool e gás carbônico. Em presença de oxigênio, o álcool pode ser convertido em ácido acético. As leveduras dispõem de maior facilidade de se desenvolverem, em microambientes, de início, há cerca de dois cm na superfície do mel quando esta já se apresenta com umidade de 22,0%, a partir, então, do manuseio, o inóculo microbiano é misturado e distribuído no produto assegurando ampla fermentação (WHITE JR, 1978; CRANE, 1979). Segundo CRANE (1979), o aumento do teor de umidade e de temperatura de estocagem do mel irá influenciar, positivamente, sobre o desenvolvimento de leveduras neste substrato contribuindo, conseqüentemente, para a pronta fermentação do produto.
Outro fator a se considerar é que mesmo quando o produto se apresenta em condição salutar o processo natural de cristalização no mel, pelo aumento de água, promove enriquecimento da fase líquida contribuindo, também, para a ocorrência de fermentação (WHITE JR, 1978).
Considerando a importância do mel e a limitada existência de pesquisas voltadas à durabilidade e manutenção de sua qualidade original, amostras oriundas de algumas áreas de cerrado do Estado de Minas Gerais, foram estudadas, sob o ponto de vista microbiológico, microscópico e físico-químico, no que tange à detecção de Salmonella sp., enumeração de bolores; leveduras e coliformes fecais e quanto à determinação do espectro polínico e teor de umidade, tendo em vista o estabelecimento da provável vida-de-prateleira deste produto apícola.
MATERIAL E MÉTODOS
Coleta, processamento e estoque do mel - favos operculados de mel, procedente de algumas áreas de cerrado do Estado de Minas Gerais, foram retirados na safra 1995-96, a partir de cinco apiários situados nos municípios de Cachoeira do Campo, Cardeal Mota, Jaboticatubas, Matozinhos e Prudente de Morais. Após centrifugação destes favos em Laboratório, 45 amostras de mel retiradas foram acondicionadas em frascos estéreis de vidro, em alíquotas de aproximadamente 1Kg. As amostras foram estudadas, no decorrer de dois, quatro, seis, oito e doze meses de estocagem, em ambiente sem contato com luz solar direta e à temperatura média de 25ºC.
Verificação de presença de Salmonella sp. e enumeração de coliformes fecais - a partir de 25g de mel, realizou-se a pesquisa de Salmonella sp. em água peptonada tamponada, Biobrás, e para a enumeração de coliformes fecais prepararam-se diluições decimais seriadas até 1/1000, fazendo-se semeadura em caldo lauril sulfato triptose, Biobrás, de acordo com VANDERZANT & SPLITTSTOESSER (1992).
Enumeração de bolores e leveduras -
uma grama da amostra foi, em triplicata, semeada por incorporação,
em ágar DG18, Oxoid, com incubação a 25ºC durante
cinco dias, segundo HOCKING & PITT (1980).
Determinação de umidade - o teor de umidade foi estabelecido
com base em leituras de índices de refração, em refratômetro
Abbé, a 20ºC, tendo estes, conforme tabela de Chataway, sido
transformados em percentagens de umidade, conforme recomendação
da AOAC(1984).
Determinação do espectro polínico - para obtenção do sedimento, 10g de mel bem homogeneizado foram dissolvidas em água destilada e centrifugadas, de acordo com BARTH (1970b), MAURIZIO (1975) e BARTH (1989). Determinações quantitativas das espécies botânicas foram realizadas, comparativamente, utilizando-se laminário de referência do Laboratório de Microscopia, Fundação Ezequiel Dias (FUNED). Para tal, a partir de cada amostra efetuaram-se contagens de 300 a 500 grãos de pólen que foram agrupados segundo classes de freqüência estabelecidas por BARTH (1970abc) e LOUVEAUX et alii (1970 e1978).
Análise estatística - resultados conjuntos referentes aos parâmetros tempo de estocagem, contagem microbiana e teor de umidade foram estudados para avaliação da correlação destes entre si, de acordo com proposições de STEEL & TORRIE (1960).
RESULTADOS E DISCUSSÃO
Em todas as 45 amostras analisadas não se evidenciou a presença de Salmonella sp., único parâmetro microbiológico prescrito pela legislação brasileira (BRASIL, 1978), e a enumeração de coliformes fecais apresentou-se da ordem de <3,0 NMP/g (dados não constantes em quadro).
A ausência destes microrganismos no mel analisado pode ser esperada, a medida que no decorrer de dois até doze meses de estocagem o teor médio de umidade que se situava no momento zero de análise próximo a 17,0% atingiu o máximo de 18,9% (Quadro 1). Estes valores de umidade, conforme JAY (1992), são considerados insuficientes para o desenvolvimento de patógenos enterais e indicadores de contaminação que exigem valores de umidade significativamente superiores, muito embora, SNOWDON & CLIVER (1996) já tenham reportado, para o mel, população de coliformes fecais que variou de 10 a 102 UFC/g, não tendo estes autores, contudo, informado sobre o conteúdo de umidade das amostras estudadas.
No que concerne aos bolores e leveduras, quando o mel foi estocado por oito e doze meses, a contagem destes indicadores de contaminação de matéria-prima e/ou de contaminação pós-processo, atingiu valores máximos de <102 e <3,0 x 102 UFC/g, respectivamente, e estas contagens ocorriam em umidade média de 18,2% e 18,9% (Quadro 1). É importante considerar, todavia, que apenas duas amostras, com umidade média de 23,0%, nestes dois períodos de oito e doze meses, apresentaram tais contagens (dado não constante em quadro), resultando, desta maneira, 43 amostras avaliadas até o período de 12 meses com contagem de bolores e leveduras situada entre <1,0 a <40UFC/g e teor de umidade próximo a 17,0%, o que corresponde a 95,5% do total de amostras estudadas (dados não constantes em quadro).
Confrontando os resultados acima, trabalho conduzido por PEREIRA et alii (1995), voltado à localização e correção de pontos críticos em apiário cuja produção se encontrava inadequada ao consumo devido a fermentação e mau odor, revelou contagem média de 3,0 x 105UFC/g de bolores e leveduras no produto mas, estas mesmas amostras, em função de oferta de condições insalubres à colméia, apresentavam, na altura, teor de umidade igual a 22,0%. Este nível de umidade então relatado, superior ao valor limite de 20,0% caracteriza umidade não tolerada por lei por, entre outros aspectos, predispor ao desenvolvimento anormal de microrganismos (BRASIL, 1985).
Apesar de os resultados evidenciados neste experimento, no que diz respeito à relativa manutenção do teor de umidade do produto ao longo de doze meses de armazenagem a 25ºC e o não significativo acréscimo do conteúdo de bolores e leveduras, pode-se, através dos dados de correlação contidos no Quadro 2, verificar que as variáveis estudadas apresentaram-se positivamente correlacionadas entre si. Isto demonstra que quanto maior o tempo de estocagem, maior será a umidade e, conseqüentemente, maior, também, será a população de bolores e leveduras (STEEL & TORRIE, 1960).
Através do entendimento destes resultados, pode-se inferir que o mel, caso não coletado, manipulado e mantido de acordo a se preservar suas características físico-químicas e microbiológicas originais, poderá, mesmo em detrimento de suas propriedades físico-químicas e antimicrobianas, vir a se apresentar fermentado.
No que concerne, finalmente, à análise microscópica, o mel procedente de algumas áreas de cerrado do Estado de Minas Gerais, mostrou-se de origem heterofloral, composto por pólen dominante de Schinus sp. e acessórios de Vernonia sp. e Eucalyptus sp. (Figura 1). A definição do espéctro polínico, em amostras de mel, permite estabelecer o padrão de identidade do produto que não se atém, com exclusividade, à sua procedência botância e, por consegüinte, geográfica, a saber pelo fato de que, conforme se cumpre realçar, as características físico-químicas e microbiológicas do mel, estão, entre si, intimamente relacionadas e dependentes.
CONCLUSÕES
Amostras de mel, de origem botânica predominante de Schinnus sp., com umidade inicial próxima a 17,0%, após doze meses de estocagem, a 25ºC, apresentaram umidade máxima de 18,9%.
Quando embalado em frascos de vidro, o mel produzido em algumas áreas de cerrado do Estado de Minas Gerais apresentou vida-de-prateleira, por um período estimado em até doze meses.
REFERÊNCIAS BIBLIOGRÁFICAS
01.ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Methods of analysis.
14ed. Arlington, 1984, 500p.
02.BARTH, O.M. Análise microscópica de algumas amostras
de mel. 1. Pólen dominante. Anais Acad. Brasil. Ciênc.,
Rio de Janeiro, v.42, p.351-66, 1970a.
03.BARTH, O.M. Análise microscópica de algumas amostras
de mel. 2. Pólen acessório. Anais Acad. Brasil. Ciênc.,
Rio de Janeiro, v.42, p.571-90, 1970b.
04.BARTH, O.M. Análise microscópica de algumas amostras
de mel. 3. Pólen isolado. Anais Acad. Brasil. Ciênc., Rio
de Janeiro, v.42, p.747-72, 1970c.
05.BARTH, O.M. O pólen no mel brasileiro. Rio de Janeiro. Luxor,
1989. 150p.
06.BONVEHI, J.S. Estudio de la validez de los indices que predicen
la cristalization de la miel. Rev. Agroquím. Tecnol. Aliment.; v.29,
n.1, p.847-62, 1989.
07.BRASIL. Ministério da Saúde. Secretaria Nacional de
Vigilância Sanitária. Divisão Nacional de Vigilância
Sanitária de Alimentos. Portaria 01/87. Diário Oficial, Brasília,
DF. 28 de janeiro de 1987.
08. BRASIL. Ministério da Saúde. Divisão Nacional
de Vigilância Sanitária de Alimentos. Portaria 13/78, Brasília,
DF, 1978.
09.CRANE, E. Honey- a comprehensive survey. Heineman, London, 1979.
Apud: SNOWDON, J.A. & CLIVER, D.O. Microrganisms in honey. Int. J.
Food Microbiol., v.31, p.1-26, 1996.
10.FARIA, J.A.F. Shelf life testing of honey. Ciênc. Tecnol.
Aliment.; v.13, n.1, p.58-66,1993.
11.GÓMEZ ,R.; CABEZAS, L.; ALCALÁ, M. et al. Determination
y calculo de la actividad del agua en diferentes muestras de miel. Alimentaria,
v.3, p.33-36,1990.
12.HOCKING, A.D. & PITT, J.I. Dicloran-glycerol medium for enumeration
of xerophilic fungi from low moisture food. Appl. Environ. Microbiol.;
v.39, p.488-492, 1980.
13.JAY, J.M. Modern food microbiology, 4th ed. Van Nortrand Rheinhold,
New York, p.38-62, 1992.
14.KRAMER, R.G. O mel. Mensagem Doce, v.42, p.11-12, 1997.
15.LOUVEAUX, J.; MAURIZIO, A.; VORWOHL, G. Methods of melissopalinology.
Bee World., v.51, p.125-38, 1970.
16.LOUVEAUX, J.: MAURIZIO, A.; VORWOHL, G. Methods of melissopalinology.
Bee World., v.59, p.139-57, 1978.
17.MAURIZIO, O. Microscopy of honey. In: Honey: a comprehensive survey.
London. Cap. 7, 1975. p.240-57.
18.PEREIRA, M.L.; BASTOS, E.M.A.F.; DAYREEL, I.O. et al. Identificação
e correção de pontos críticos em um apiário.
Ciênc. Tecnol. Aliment., v.16, n.1., p.48-51, 1996.
19.SNOWDON, J.A. & CLIVER, D.O. Microrganisms in honey. Int. J.
Food Microbiol., v.31, p.1-26, 1996.
20. STEEL, R.G.D. & TORRIE, J.H. Principles and procedures of statistics
with special reference to the biological sciences. McGraw Hill, New York,
p.481, 1960.
21.VANDERZANT, C. & SPLITTSTOESSER, D.F. Compendium for the microbiological
examination of foods. American Public Health Association. 3 ed. Washington,
DC., 1992. 1219p.
22.WHITE JR, J.W. Physical characteristics of honey. GRANE, E.
ed. Honey: a comprehensive survey. New York, Russak & Company, 1976.
23.WHITE JR., J.W. Honey. Adv. Food Res. , v.24, p. 287-374, 1978.
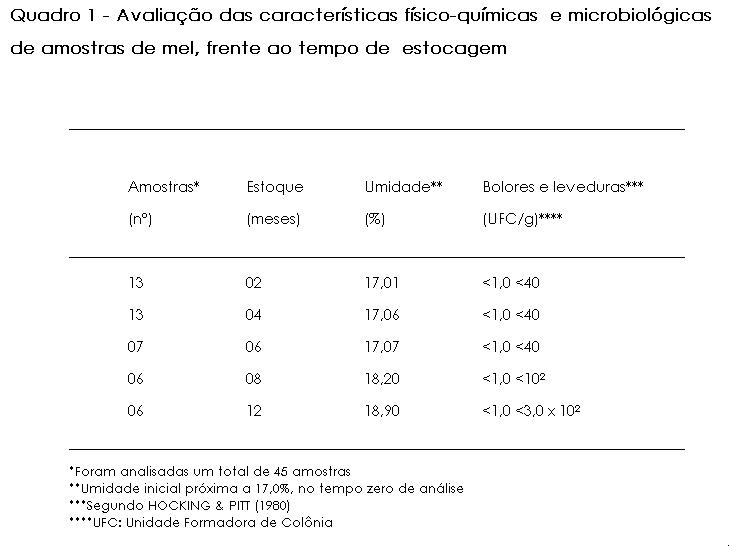
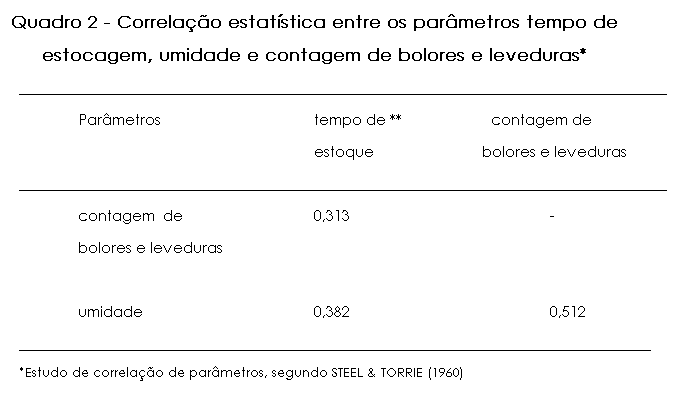

a: Schinnus sp. (aroeira) |
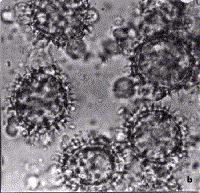
b: Vernonia sp. (assa-peixe) |

c: Eucalyptus sp. |
Figura 1 - Microfotografia de grãos de pólen, em amostras
de mel procedente de áreas de cerrado do Estado de Minas Gerais