Artigo
COMPOSIÇÃO QUÍMICA, ATIVIDADE BIOLÓGICA E SEGURANÇA DE USO DA PRÓPOLIS VERMELHA
Maria Cristina Marcucci Ribeiro*1; Alexandra Christine Helena Frankland Sawaya2; Niraldo Paulino1; Susana Nogueira Diniz1; Sergio de Mendonça1; Naiara Carvalho Rodrigues3; Begoña Giménez Cassina-López2.1Programa de Mestrado Profissional em Farmácia da Universidade Bandeirante de São Paulo, UNIBAN. Rua Maria Cândida, 1813 - 5º. Andar, V.Guilherme, São Paulo, SP, Brasil, CEP 02071-013;
2 Departamento de Fisiologia Vegetal do Instituto de Biologia da Universidade Estadual de Campinas, UNICAMP, Bloco J Térreo, Campinas, SP, Brasil, CEP 13083-970;
3 Mestre pelo Programa de Mestrado Profissional em Farmácia da Universidade Bandeirante de São Paulo, UNIBAN. Rua Maria Cândida, 1813 - 5º. Andar, V.Guilherme, São Paulo, SP, Brasil, CEP 02071-013.
*autor para correspondência: mcristinamarcucci@gmail.com.
PALAVRAS-CHAVE: própolis vermelha, composição química, atividade antioxidante, atividade antimicrobiana, segurança de uso.
INTRODUÇÃO
A própolis, uma resina fabricada pelas abelhas a partir de material coletado em brotos e exudatos de plantas, possui uma composição química bastante complexa e variada, estando intimamente relacionada com a ecologia da flora de cada região a qual as abelhas visitam (PIETTA et al., 2002). Esta composição varia de acordo com a sua origem botânica. Por exemplo, em regiões de zonas temperadas do planeta, onde crescem plantas do gênero Populus, resina preferida pelas abelhas para sua elaboração, foram encontrados muitos flavonóides, entre eles a pinobanksina, pinocembrina e quercetina. Entretanto, em países de clima tropical onde a vegetação é distinta, a composição química da própolis é totalmente diferente das primeiras. Como a composição química da própolis varia, é de se esperar que a sua atividade biológica também não seja a mesma. As atividades biológicas da própolis brasileira variam regionalmente, de acordo com as fontes vegetais de suas resinas. O grupo de pesquisa de Marcucci e colaboradores (2013) já analisou inúmeras amostras de própolis provenientes das regiões sul e sudeste do Brasil por cromatografia líquida de alta eficiência (HPLC) as quais, após a quantificação, foram avaliadas estatisticamente através de um programa de análise multivariada.
Foi possível observar três tipos de própolis denominadas: BRP, BRG e BRPG; com base nos seus principais marcadores químicos (MARCUCCI, 2000), num procedimento denominado "tipificação da própolis". A própolis verde, a mais popular e mais comercial, é denominada de BRP. Foi descoberto que o alecrim (Baccharis dracunculifolia) é uma excelente fonte de resina para a produção da própolis BRP no Brasil. Midorikawa et al. (2001) identificaram a presença de Artepillin C, ácido 4-hidroxi-3-prenilcinâmico, ácido p-cumárico e canferide em amostras de própolis brasileira, denominada de BRP (MARCUCCI, 2000). Sawaya et al. (2004) usaram cromatogramas obtidos por "electrospray ionization mass spectrometry" para caracterizar e identificar amostras de própolis oriundas da Europa, EUA, África e das diferentes regiões do Brasil, identificando os seguintes componentes: ácido p-cumárico, 3-metoxi-4-hidroxicinamaldeido, 2,2-dimetil-6-carboxietenil-2H-1-benzopirano, ácido 3-prenil-4-hidroxicinâmico, crisina, pinocembrina, ácido 3,5-diprenil-4-hidroxicinâmico (Artepillin C), ácidos dicafeoilquínicos, entre outros.
No Brasil, um novo tipo de própolis popularmente conhecida como própolis vermelha é coletada nas regiões norte e nordeste, especialmente em Alagoas. Este tipo de própolis é considerado típico de Cuba (TRUSHEVA et al., 2006). A própolis vermelha, típica de Cuba, teve a sua fonte vegetal identificada como sendo a Clusia nemorosa (Clusiaceae) (CUESTA-RUBIO et al, 2002) e na Venezuela, as abelhas a coletam de Clusia scrobiculata (Figuras 5 e 6, TRUSHEVA et al., 2004). A própolis vermelha possui composição química distinta da própolis verde e das outras própolis estudadas até o momento. Na própolis vermelha brasileira, foram isolados e identificados vários compostos, sendo que alguns deles são novos para a própolis.
Estes compostos pertencem a diferentes classes, tais como: fenólicos, triterpenóides, isoflavonóides, benzofenonas preniladas e um epóxido da naftoquinona (isolado pela primeira vez em um produto natural (TRUSHEVA et al, 2006)). Alguns dos compostos isolados mostraram significativa atividade antimicrobiana e antioxidante. Trusheva et al. (2006) analisaram vinte frações de própolis vermelha do nordeste brasileiro e identificaram catorze compostos, dentre eles: fenóis, triterpenóides, isoflavonóides, benzofenonas preniladas e a naftoquinonas. Segundo Trusheva et al. (2006), a própolis vermelha possui atividade antimicrobiana contra Staphylococcus aureus, Escherichia coli e Candida albicans e apresentou também atividade antioxidante, anti-inflamatória, anticarcinogênica e antiprotozoária (TRUSHEVA et al., 2006; AYRES et al., 2007).
A identificação de novos constituintes em própolis vermelha, muitos deles possuindo atividade biológica, é apenas uma confirmação de que esta própolis possui estas atividades, independentemente da sua fonte vegetal, mas que pode variar em sua intensidade. A descoberta de outros compostos com atividades biológicas variadas levará a incluí-la na tipagem e assim propor novos medicamentos opoterápicos (ANVISA, 2005) com este produto apícola valioso.
1 FONTES VEGETAIS E COMPOSIÇÃO QUÍMICA
1.1 Fontes vegetais
Diferentemente dos países de clima temperado, no Brasil, a rica composição da flora, oferece às abelhas um grande número de plantas resiníferas de onde as mesmas coletam as secreções para o processo de propolização. A principal fonte botânica para a produção da própolis da região sudeste do Brasil é a resina coletada das espículas foliculares de Baccharis dracunculifolia L. (Asteraceae), conhecida popularmente como alecrim-do-campo ou vassourinha, devido a seu uso na produção de vassouras, foi considerada uma planta invasora de pastagens e erradicada de muitas regiões em função disto. Atualmente sabe-se que é através da coleta de resina pelas abelhas nesta planta é que elas produzem a própolis verde (Marcucci e Bankova, 1999; SAWAYA et al, 2011).
No sul do Brasil, além da B. dracunculifolia L., as resinas secretadas por espécies de coníferas, Araucaria angustifolia L., conhecida por pinheiro serrano e por Eucalipto citriodora, mas ao sul do Brasil (MARCUCCI et al, 2000; MIDORIKAWA, 2004; SAWAYA et al, 2004) contribuem decisivamente para a produção de própolis.
A própolis vermelha, entretanto, apresenta coloração vermelho intenso, e é coletada nas regiões do nordeste ligadas ao ecossistema de mangues.
DAUGSCH (2007) concluiu que a principal origem botânica da própolis vermelha seria a Dalbergia ecastophyllum (D.ecastophyllum). Coletaram amostras de própolis vermelha de cinco estados do nordeste brasileiro (Bahia, Sergipe, Alagoas, Pernambuco e Paraíba) comparando-as através de testes em Cromatografia em Camada Delgada de Alta Eficiência em Fase Reversa (HPTLC) e Cromatografia Liquida de Alta Eficiência em Fase Reversa (HPLC) com resinas da D. ecastopyllum (rabo de bugio) constataram perfis muito similares. Foi avaliada a origem botânica e a composição química de um tipo de própolis brasileira, de coloração vermelha, mostrando ser provável que a mesma tenha origem na D.ecastophyllum, bem como apresentando um alto percentual de iso-flavonóides. Até o momento, não foi possível concluir que a resina utilizada na elaboração de própolis vermelha seja exclusivamente de rabo de bugio. Apesar da pequena oferta de trabalhos na literatura científica sobre a própolis vermelha brasileira, os resultados obtidos relativos à sua composição têm demonstrado um grande potencial biológico deste tipo de própolis quando comparada com outros tipos já estudados e relatados.
1.2 Composição química
Foram avaliadas amostras de própolis vermelhas do nordeste do Brasil, incluindo as de Maceio-AL e de João Pessoa-PB. Feng et al. (2008) isolaram vários flavonóides de própolis vermelhas. Os compostos isolados pelos autores, pertencentes às classes de flavonoides, a saber: (2S)-7-hidroxiflavanona, (2S)-liquiritigenina, (2S)-7-hidroxi-6-metoxiflavona, (2S)-narigenina, (2S)-diidrobaicaleína, (2S)-diidroroxilina A, (2R, 3R)-3,7-diidroxiflanona, garbanzol, (2R, 3R)-3,7-diidroxi-6-metoxiflavona, aunustinol, alnusina, daidzeína, formonetina, calicosina, xenognosina, biochanina A, pratenseína, 2'-hidroxibiochanina A, (3S)-vestitona, (3S)-violanona, (3S)-ferreirina, (3R)-4'-metoxi-2',3,7-triihidroxiisoflavanona, (3S)-vestitol, (3S)-isovestitol, (3S)-7-O-metilvestitol, (3S)-mucronulatol, 2',4'-diihidroxichalcona, isoliquiritigenina, 4,4'-diidroxichalcona,(aS)-a,2'4,4'-tetraidroxiidrochalcona,2,6-diidroxi-2-[(4-hidroxi-fenil)metil]-3-benzofuranona, (6aS, 11aS)-medicarpina, (6aS, 11aS)-3,10-diidroxi-9-metoxipterocarpano, (6aS ,11a ) -3-hidroxi-8, 9-dimetoxipterocarpano, (6aS,11aS)-6a-etoximedicarpina, (6aR,11aR)-3,4-diidroxi-9-metoxipterocarpano, (6aR,11aR)-4-metoximedicarpina e (7S)-dalbergifenol. A própolis verde tipificada (BRP) apresenta um teor médio em torno de 2-3% (m/m) de flavonóides totais. Explica-se aqui a elevada concentração destas substâncias nas frações devido à presença desta vasta quantidade de flavonoides. Marcucci et al. (2006) foram os primeiros pesquisadores brasileiros a relatar a existência de compostos químicos novos em própolis vermelhas brasileiras.
2 ATIVIDADES BIOLÓGICAS
2.1 Atividade antioxidante
A atividade antioxidante, avaliada pelo método da descoloração do radical livre DPPH, é bastante alta, tendo-se encontrado valores entre 5 e 10 µg/mL, sendo que para a própolis verde, esta atividade encontra-se na faixa de 15-20 µg/mL.
2.2 Atividade antitumoral
Feng et al. (2008) avaliaram a atividade citotóxica de trinta e nove flavonóides e três lignanas isoladas de própolis vermelha brasileira contra seis linhagens de células tumorais in vitro, verificando a relação estrutura-atividade. Todos os compostos testados mostraram um potencial antitumoral. Flavanonas, isoflavonas e isoflavanonas apresentaram citotoxicidade em células de carcinoma de colon (linhagem 26-L5).
O efeito citotóxico do extrato alcoólico da própolis vermelha foi avaliado em células leucêmicas da linhagem Jurkat e observou-se uma significativa atividade citotóxica (IC50 = 24 µg/mL), após 24h de cutura. Estes dados comprovam a ação citotóxica da propólis vermelha já verificada em outras linhagens de células leucêmicas humanas que apresentaram valores de IC50 muito semelhantes (entre 20 e 50 µg/mL) (FRANCHI et al, 2012).
A atividade antitumoral da própolis vermelha foi relacionada com sua capacidade de inibir o crescimento tumoral, não só pela sua ação citotóxica, mas também pelos efeitos supressores contra a angiogênese induzida por VEGF (IZUTA et al., 2009). É importante ressaltar que a própolis vermelha reduziu lesões arterioescleróticas por mecanismos relacionados com a modulação da resposta inflamatória e de fatores angiogênicos (DALEPRANE et al., 2012). Entretanto, estudos de isolamento dos componentes químicos da própolis vermelha para identificação da sua atividade se fazem necessários.
2.3 Atividade antibacteriana
A função principal da própolis na colméia é a eliminação de micro-organismos que as abelhas podem trazer em seus vôos de coleta. Diversos estudos, de fato, demonstraram a atividade antibacteriana de extratos de própolis, principalmente verde, para bactérias Gram-positivas.
O extrato de própolis vermelha dissolvido em álcool (10mg/mL) foi avaliado quanto à atividade antibacteriana frente às bactérias Bacillus cereus (ATCC 11778), Staphylococcus epidermidis (ATCC 12228), Enterococcus faecalis (ATCC 29212), Staphylococcus aureus (ATCC 29213), Helicobacter pylori (ATCC 700392), Escherichia coli (ATCC 9637), e Salmonella enterica (ATCC 14028) pelo método qualitativo de difusão em discos impregnados com 10 µL de própolis. As própolis com atividade para as bactérias estudadas foram avaliadas quanto à concentração bactericida mínima pelo método de microdiluição, seguido de plaqueamento (Tabela 1).

Os resultados encontrados mostraram que a própolis vermelha apresenta atividade antibacteriana para as bactérias Gram-positivas analisadas, como Enterococcus faecalis e Staphylococcus aureus associadas com infecções hospitalares, e Helicobacter pylori, bactéria Gram-negativa associada com gastrites, úlceras gástricas e duodenais e câncer gástrico. Os baixos valores de concentração bactericida encontrados, em torno de 0,25 a 0,5 mg/mL, são fortemente sugestivos de sua utilização em terapêutica complementar, ou mesmo o desenvolvimento de medicamentos com os compostos ativos desta própolis.
3 AVALIAÇÃO DA SEGURANÇA DE USO DA PRÓPOLIS
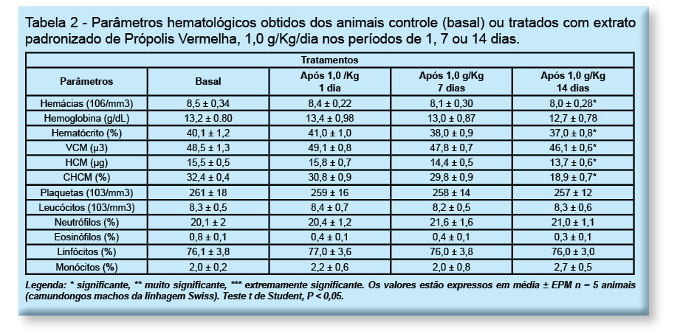
No ensaio para determinação do grau de toxicidade - investigação da dose letal 50 % (DL50) foi demonstrado que até a dose de 1g/kg não houve morte de camundongos Swiss, nos grupos tratados com o extrato de própolis vermelha. Os animais foram acompanhados por 28 dias. Com respeito à avaliação dos parâmetros hematológicos nos animais tratados com extrato padronizado de própolis vermelha, após 1, 7 ou 14 dias, foi coletado o sangue dos camundongos e não foi observada alteração, quando analisados nos tempos de 1 ou 7 dias de tratamento. Porém, depois de 14 dias de tratamento, houve alteração estatisticamente significativa nos parâmetros: hemácias totais, hematócrito, VCM (volume corpuscular médio), HCM (Hemoglobina Corpuscular Média) e CHCM (Concentração de Hemoglobina Corpuscular Média), conforme descrito na tabela 2.
Notou-se alteração somente nas células vermelhas (eritrograma), o que significa que não houve alteração estatisticamente significativa, nas células brancas (leucograma): leucócitos, neutrófilos, eosinófilos, linfócitos e monócitos.
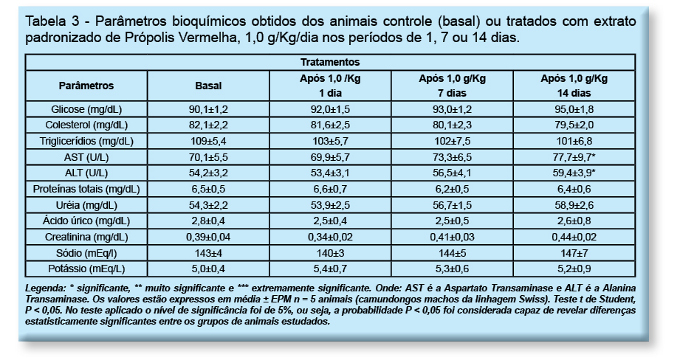
Com respeito à avaliação dos parâmetros bioquímicos, animais foram tratados com o extrato de própolis vermelha com a dose de 1 g/kg/dia por via oral. Após 1, 7 ou 14 dias o sangue destes animais foi coletado e não houve alteração estatisticamente significativa dos parâmetros bioquímicos (AST, ALT, ácido úrico, triglicerídios, ácido úrico, uréia, proteínas totais, sódio e potássio) quando analisados nos períodos de 1 ou 7 dias de tratamento. Entretanto, a avaliação bioquímica do sangue dos animais tratados por 14 dias demonstrou alteração significativa dos parâmetros relacionados à função hepática (AST e ALT), conforme descrito na tabela 3.
As alterações bioquímicas podem ter ocorrido devido à presença dos compostos fenólicos que são metabolizados preferencialmente no fígado. Houve alteração bioquímica discreta somente na função hepática, o que foi estatisticamente significativo, enquanto que nos parâmetros de carboidratos / gordura (glicose, colesterol e triglicerídeos) e na função renal (uréia, ácido úrico, creatinina, sódio e potássio) não foi estatisticamente significativo.
Um dos pontos que deve ser levado em consideração sobre a toxicidade de um produto natural, é a produção de hipersensibilidade do mesmo em humanos. Algumas moléculas presentes na natureza podem combinar-se com proteínas do organismo e tornarem-se imunogênicas, funcionando como haptenos e sensibilizando o sistema imune. Estudos recentes demonstraram que algumas substâncias presentes na própolis podem produzir o quadro de hipersensibilidade. Um número relativamente grande de relatos na literatura tem chamado a atenção para as reações adversas associadas ao uso da própolis, ou ao contato com ela. Entre as principais reações descritas, as mais importantes são as que se referem a reações alérgicas e de hipersensibilidade ao contato com a própolis. A dermatite de contato ocupacional devido ao uso de própolis cutâneo foi descrita em muitos relatos associadas com a própolis de origem Européia (DOWNS e SANSOM 1998; CALLEJO 2001, TERAKI 2001).
Algumas propriedades biológicas e toxicológicas da própolis Européia foram revisadas por BURDOCK (1998), onde se chama a atenção para o grande número de reações alérgicas que se agravam pelo uso da própolis também como suplemento alimentar. Apesar deste relato, o trabalho descreve que em estudos animais envolvendo camundongos, que receberam doses de própolis de até 1.400mg/Kg de peso, nenhuma resposta tóxica foi observada imediatamente após o uso.
Apesar destes relatos de reações adversas, as possibilidades terapêuticas associadas à própolis e adversidade de efeitos benéficos que esta resina natural pode trazer, justifica o seu uso, ainda que com as ressalvas de um pequeno grupo de indivíduos que apresentem reações adversas ou de hipersensibilidade.
CONCLUSÕES
A abelha, pela sua versatilidade, é conhecida como modelo de vida social. Fornece ao homem alimentos de qualidades importantes, além de contribuir para o processo de polinização das plantas. Um de seus produtos, a própolis, nestas últimas décadas, deixou de ser descartada pelos apicultores e passou a integrar o contexto dos outros produtos apícolas comerciais. Nesse contexto, a própolis vermelha vem tendo seu valor cada vez mais reconhecido devido às suas propriedades biológicas e terapêuticas.
NOTA
Este artigo é parte integrante do capítulo de livro intitulado: "Atualizações na pesquisa com própolis vermelha de Alagoas: composição química, atividade biológica e avaliação da segurança de uso como apiterápico" ainda não publicado.
Referências
ANVISA (Agência Nacional de Vigilância Sanitária) Nota Técnica sobre o Registro de Produtos Contendo Própolis, de 14 de setembro de 2005.
AYRES, D.C., MARCUCCI, M.C., GIORGIO, S. Effects of brazilian propolis in Leishmania amazonensis, Memórias do Instituto Oswaldo Cruz 102, 215-220, 2007.
BURDOCK, G. A. Review of the biological properties and toxicity of bee propolis. Food Chemistry and Toxicology 36, 347-363, 1998.
CALLEJO, A., ARMENTIA, A., LOMBARDERO, M., ASENSIO, T. Propolis, a new bee-related allergen. Allergy 56, 579-591, 2001.
CUESTA-RUBIO O., FONTANA-URIBA, B.A., RAMIREZ-APAN T., CARDENAS J. (2002). Polyisoprenylated benzophenones in Cuban propolis: biological activity of nemorosone Zeitschrift fur Naturforschung 57, 372 - 378.
DAUGSCH, A.; Própolis vermelha do nordeste do Brasil e suas características químicas e biológicas / Andreas Daugsch. -2007. 265p. Tese (doutorado) - Universidade Estadual de Campinas. Faculdade de Engenharia de Alimentos. Campinas, SP.
DOWNS, A.M., SANSOM, J.E. Occupational contact dermatitis due to propolis. Contact Dermatitis 38, 359-360, 1998.
FENG, L., AWALE, S., TEZUKA, Y., KADOTA, S. Cytotoxic Constituents from Brazilian Red Propolis and Their Structure-activity Relationship. Bioorganic and Medicinal Chemistry 16, 5434-5440, 2008.
FRANCHI JR., G.C., MORAES, C.S., TORETI, V.C., DAUGSCH, A, NOWILL, A.E., PARK, Y.K.. Comparison of effects of the ethanolic extracts of brazilian propolis on human leukemic cells as assessed with the MTT assay. Evidence Based Complementary and Alternative Medicine. Volume 2012, Article ID 918956, 6 pages, doi:10.1155/2012/918956
IZUTA, H., SHIMAZAWA, M., TSURUMA, K., ARAKI, Y., MICHIMA, S., HARA, H. Bee products prevent VEGF-induced angiogenesis in human umbilical vein endothelial cells. BMC Complementary and Alternative Medicine 17, 9-45, 2009.
MARCUCCI, M.C. (2000). Processo de identificação de tipagens da própolis Brasileira. Pedido de Patente no INPI (Brasil): PI0006272.
MARCUCCI, M.C., BANKOVA, V.S. Chemical Composition, Plant Origin and Biological Activity of Brazilian Propolis, Current Topics in Phytochemistry , 2, 116-123, 1999.
MARCUCCI, M.C., FERRERES, F., CUSTODIO, A.R., FERREIRA, M.M.C., BANKOVA, V.S., GARCÍA-VIGUERA, C., BRETZ, W.A. Evaluation of Phenolic Compounds in Brazilian Propolis from Different Geographic Regions, Zeitschrift für Naturforschung, 55C, 76-81, 2000.
MARCUCCI, M.C., PAULINO, N., SAWAYA, A.C.H.F. Grupo de trabalho em pesquisas sobre a própolis tipificada e a vermelha de Alagoas. UNIBAN e UNICAMP, 2013.
MIDORIKAWA, K.; BANSKOTA, A.H.; TEZUKA, Y.; NAGAOKA, T.; MATSUSHIGE, K.; MESSAGE, D; HUERTAS, A.A.G.; KADOTA, S. (2001). Liquid Chromatography-Mass Spectrometry Analysis of Propolis. Phytochemical Analysis, 12, 366-373, 2001.
PIETTA, P.G.; GARDANA, C.; PIETTA, A.M. (2002). Analytical Methods for Quality Control of Propolis. Fitoterapia. 73 Suppl. 1p. S7-S20.
SAWAYA, A.C.H.F., TOMAZELA, D.M., CUNHA IBS, BANKOVA, V.S., MARCUCCI, M.C., CUSTODIO, A.R., EBERLIN M.N. (2004). Electrospray ionization mass spectrometry fingerprinting of propolis. Analyst, 129, 739-744.
SAWAYA, A.C.H.F., CUNHA, I.B.S., MARCUCCI, M.C., Analytical methods applied to diverse types of Brazilian propolis. Chemistry Central Journal 5, 27-48, 2011.
TERAKI, Y., SHIOHARA, T. Propolis-induced granulomatous contact dermatitis accompanied by marked lymphadenopathy. British Journal of Dermatology 144, 1277-1278, 2001.
TRUSHEVA, B., POPOVA, M., NAYDENSKI, H., TSVETKOVA, I., RODRIGEZ, J.G., BANKOVA, V. (2004). New polyisoprenylated benzophenones from Venezuelan propolis. Fitoterapia 75, 683 - 689.
TRUSHEVA, B., POPOLVA, M., BANKOVA, V., SIMOVA, S., MARCUCCI, M.C., MIORIN, P.L., PASIN, F.R., TSVETKOVA, I. (2006). Bioactive Constituents of Brazilian Red Propolis, e-CAM 3, 249-254.