Artigo
A abelha polinizadora da aboboreira e medidas de proteção aos polinizadores em áreas de cultivo
Tereza Cristina Giannini1; Antonio Mauro Saraiva2; Isabel Alves-dos-Santos11. Instituto de Biociências da Universidade de São Paulo
2. Escola Politécnica da Universidade de São Paulo
giannini@usp.br
As abelhas do gênero Peponapis (Apidae, Eucerini) ocorrem nas Américas, desde o Canadá até a Argentina. No Brasil ocorre uma única espécie: a Peponapis fervens Smith 1879 (Figura 1). Essa abelha apresenta vida solitária, ou seja, não forma colméia, e a fêmea fundadora constrói seu ninho no solo. Em cada célula onde o ovo é depositado, a fêmea coloca uma mistura de pólen e néctar para que a larva possa se alimentar. No caso de P. fervens, o pólen coletado para alimentar a cria trata-se especificamente do pólen das flores das aboboreiras (Cucurbita) (Hurd et al., 1971).

dentro da flor (foto, cedida por
Cristiane Krug)
A aboboreira é monóica, ou seja, as flores masculinas e femininas estão em plantas separadas. Isto implica que para a fecundação das flores femininas é necessário a ação de um agente polinizador que irá transferir os grãos de pólen contendo os gametas masculinos para o estigma da flor feminina, realizando assim a polinização cruzada. Deste processo resulta a formação dos frutos da aboboreira.
As abelhas P. fervens, por serem especialistas em Cucurbita e dependerem das mesmas para a procriação, visitam as flores com alta freqüência e são excelentes polinizadores, pois carregam na pilosidade de seu corpo, 100% de pólen de Cucurbita (Krug et al., 2010).
A polinização cruzada também garante a formação de sementes viáveis e frutos de melhor qualidade. Como as aboboreiras são importantes cultivos agrícolas, a polinização executada pelas abelhas Peponapis é fundamental para a produtividade e qualidade de seus frutos.
Na América do Norte, levantamentos de abelhas em campos cultivados de abóboras demonstraram que Peponapis pruinosa esteve presente em praticamente todos os campos (Cane, 2005; Shuler et al., 2005). Tepedino (1981) considerou desnecessária a utilização da abelha melífera (Apis mellifera) para polinizar as flores de abóbora em áreas com alta densidade populacional de Peponapis. No Brasil, P. fervens foi registrada em cultivos de abóboras por Gomes (1991) em Minas Gerais, por Weiss & Melo (2007) no Paraná e por Krug et al. (2010) em Santa Catarina.
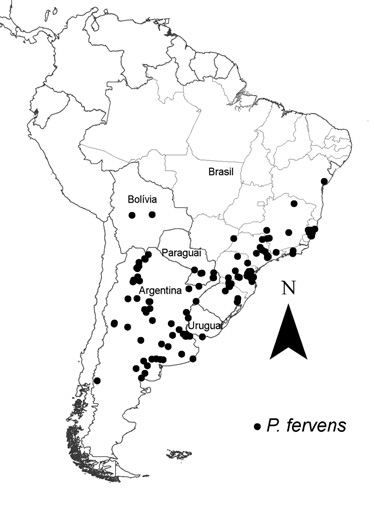
P. fervens (número de pontos de ocorrência = 170) (retirado e
modificado de Giannini et al., 2010).
Como mencionado acima, as abelhas da abóbora constroem seus ninhos no solo, em áreas adjacentes ao cultivo de aboboreiras. As fêmeas iniciam a atividade ao amanhecer, o que corresponde ao horário de abertura das flores. Os machos visitam as flores de aboboreira para tomar néctar e buscar as fêmeas para cópula. É comum encontrar machos de P. fervens "dormindo" dentro das flores fechadas no final do dia e ao longo da noite (Linsley, 1960).
A distribuição geográfica da abelha da abóbora que ocorre no Brasil pode ser observada na Figura 2. As ocorrências estão distribuídas na Argentina, Uruguai, Paraguai, Bolívia e Brasil. No Brasil, os pontos de ocorrência localizam-se em 58 municípios nos seguintes estados: Rio Grande do Sul, Santa Catarina, Paraná, São Paulo, Rio de Janeiro, Espírito Santo, Bahia, Minas Gerais e Mato Grosso do Sul.
As áreas de ocorrência no Brasil estão associadas com regiões originalmente de florestas úmidas do Sul e Sudeste, hoje amplamente utilizadas para cultivos agrícolas e pastagem. São observadas também ocorrências em áreas de cerrado de Minas Gerais, São Paulo e Mato Grosso do Sul.
As aboboreiras tem sido cultivadas nas Américas há pelo menos 10.000 anos (Ferreira, 2008). As espécies de Cucurbita que ocorrem na América do Sul incluem quatro espécies cultivadas: a abóbora chila ou gila (C. ficifolia), moranga (C. maxima), abóbora (C. moschata) e aboborinha ou mogango (C. pepo). Apenas essa última espécie (C. pepo) teve origem na América do Norte e foi, posteriormente, introduzida na América do Sul, enquanto que as demais são originárias desse continente (Nee, 1990).
Além dessas quatro espécies, ocorre também na América do Sul uma espécie não cultivada chamada Cucurbita maxima andreana. Segundo Hurd et al. (1971), P. fervens esteve, inicialmente, distribuída nas áreas de ocorrência dessa espécie não domesticada. A partir do cultivo das outras espécies de aboboreira, a abelha teria expandido sua distribuição para outras áreas do continente (Hurd et al., 1971). Atualmente, C. maxima andreana ocorre apenas no Uruguai, Bolívia e Argentina.
Os polinizadores tem estado sob ameaça, e seu declínio tem sido enfatizado na literatura, principalmente à partir da década de 1990 (Buchmann & Nabhan, 1996). As maiores causas de declínio dos polinizadores são a perda de habitat e práticas agrícolas muito agressivas (Kearns et al., 1998).
Recentemente, Vaughan & Skinner (2008) elaboraram uma série de sugestões de manejo de áreas agrícolas para conservação de polinizadores (Box 1), sendo uma delas, a manutenção de áreas com vegetação natural ao redor de campos de cultivo. Essa medida também foi sugerida como uma boa prática para manutenção das comunidades de polinizadores por outros autores. Por exemplo, Marco & Coelho (2004) demonstraram em Viçosa (MG) que as fazendas de café próximas a fragmentos florestais aumentaram aproximadamente 15% a produção, quando comparadas com outras fazendas distantes de áreas naturais. Os autores sugerem que, além dos fragmentos oferecerem recursos alimentares extras e locais de nidificação para os polinizadores, essas áreas podem também atuar no controle de pragas dos cultivos, devido à presença potencial de predadores naturais.
A diminuição dos agentes polinizadores é preocupante, pois além do impacto sobre a reprodução das espécies vegetais em áreas naturais, implica também na diminuição da produção de alimentos ou na qualidade dos mesmos. Nesse sentido, o conhecimento sobre esses agentes e as interações que eles estabelecem com suas plantas e com o ambiente é crucial para que políticas de proteção possam ser efetivadas.

precipitação, temperaturas máximas
e mínimas das áreas de ocorrência
da abelha da abóbora P. fervens
(número de pontos de ocorrência = 170)
(retirado e modificado de Giannini
et al., 2010).
Referências
Buchmann, S. L.; Nabhan, G. P. 1996. The Forgotten Pollinators. Washington, DC. Island.
Cane, J. 2005. Squash Pollinators of the Americas Survey (SPAS). USDA. Agricultural Research Service. http://www.ars.usda.gov/.
Donadio, L.C.; Gravena, S. 1994. Manejo integrado de pragas. Campinas, Fundação Cargill.
Ferreira, M. A. J. F. 2008. Abóboras e morangas das Américas para o Mundo. In: Barbieri, R. L.; Stumpf, E. R. T. (eds). Origem e evolução de plantas cultivadas. Brasília: Embrapa Informação Tecnológica.
Giannini, T. C.; Saraiva. A. M.; Alves dos Santos, I. 2010. Ecological niche modeling and geographical distribution of pollinator and plants: A case study of Peponapis fervens (Smith, 1879) (Eucerini: Apidae) and Cucurbita species (Cucurbitaceae). Ecological Informatics 5, 59-66.
Gomes, M. F. F. 1991. Polinização entomófila na produção de sementes híbridas (C. maxima x C. moschata). Mestrado. Universidade Federal de Viçosa. Minas Gerais, Brasil.
Hurd, P. D. Jr.; Linsley, E. G.; Whitaker, T. W. 1971. Squash and gourd bees (Peponapis, Xenoglossa) and the origin of the cultivated Cucurbita. Evolution 25, 218-234.
Kearns, C. A.; Inouye, D. W.; Waser, N. M. 1998. Endangered mutualisms: the conservation of plant-pollinator interactions. Annual Review of Ecology, Evolution, and Systematics 29, 83-112.
Krug, C.; Alves-dos-Santos, I.; Cane, J. 2010. Visiting bees of Cucurbita flowers (Cucurbitaceae) with emphasis on the presence of Peponapis fervens Smith (Eucerini - Apidae) - Santa Catarina, Southern Brazil. Oecologia Australis 14, 128-139.
Linsley, E. G. 1960. Observations on some matinal bees at flowers of Cucurbita, Ipomoea and Datura in desert areas of New Mexico and Southeastern Arizona. New York Entomological Society 68, 13-20.
Marco Jr., P.; Coelho, F. M. 2004. Services performed by the ecosystem: forest remnants influence agricultural cultures' pollination and production. Biodiversity and Conservation 13, 1245-1255.
Nee, M. 1990. The domestication of Cucurbita (Cucurbitaceae). Economic Botany 44, 56-68. Nogueira Neto, P. 1997. Vida e Criação das abelhas indígenas sem ferrão. São Paulo, Nogueirapis. A edição está esgotada, mas existe uma versão em http://eco.ib.usp.br/beelab/pdfs/livro_pnn.pdf.
Shuler, R. E.; Roulston, T. H.; Farris, G. E. 2005. Foraging practices influence wild pollinator populations on squash and pumpkin. Journal of Economic Entomology 98, 790-5.
Tepedino, V. J. 1981. The pollination efficiency of the squash bee (Peponapis pruinosa) and the honey bee (Apis mellifera) on summer squash (Cucurbita pepo). Journal of Kansas Entomology Society 54, 359-377.
Vaughan, M.; Skinner, M. 2008. Using Farm Bill Programs for Pollinator Conservation. Technical note 78. U.S. Department of Agriculture (USDA), Natural Resources Conservation Service (NRCS), NRCS National Plant Data, The Xerces Society Invertebrate Conservation, and S. Francisco State University.
Weiss, G.; Melo, G. A. R. 2007. Comportamento forrageiro de Peponapis fervens Smith (Hymenoptera, Apidae, Eucerini) em flores de Cucurbita (Cucurbitaceae). Anais do VIII Congresso de Ecologia do Brasil, 23 a 28 de Setembro de 2007, Caxambu - MG.
Box 1. Medidas sugeridas para proteção de polinizadores em áreas agrícolas (retirado e modificado de Vaughan & Skinner 2008)
1.Para aumentar a disponibilidade de recursos (pólen e néctar):
Proteger as áreas de vegetação nativa que existam próximas às áreas de cultivo;
Introduzir plantas que possam ser usadas como fontes de recursos em vielas no meio da área de cultivo, ou na borda de canais de água, em áreas de rotação de cultivos, em linhas de contenção em ribanceiras para evitar a erosão, nas bordas das áreas de cultivo, em barreiras contra o vento e em cercas vivas.
As plantas utilizadas podem incluir árvores, arbustos ou herbáceas, que devem ser nativas da região e, preferencialmente, florescer em épocas diferentes, de tal forma que sempre haja recursos extras disponíveis ao longo do ano.
2.Para aumentar a disponibilidade de locais de nidificação:
Proteger as áreas de vegetação nativa que existam próximas das áreas de cultivo;
Introduzir espécies de árvores nativas que podem ser plantadas segundo as sugestões do item anterior;
Em áreas adjacentes de vegetação, caso hajam árvores mortas que permaneçam em pé, estas devem ser mantidas e podem ser feitos furos no tronco com, aproximadamente 12-18cm de profundidade que possam servir de ninhos para espécies solitárias.
Oferecer ninhos artificiais para as abelhas, como caixas de madeira para as espécies sociais ou blocos de madeira com furos para as solitárias (detalhes sobre caixas para espécies sociais foram publicados em Nogueira Neto 1997). Estes podem ser mantidos próximos às áreas de vegetação, protegidos do uso de pesticidas ou de manejo agrícola.
3.Uso de pesticidas:
A implementação de Manejo Integrado de Pragas (MIP) em cultivos reduz o impacto causado pelo uso de substâncias químicas (detalhes sobre esse tipo de manejo foram publicados em Donadio e Gravena 1994).
Considerar o uso de organismos que possam ajudar no controle biológico - porém, isso deve ser feito com cautela e com a supervisão de um profissional competente.
Caso existam áreas próximas que porventura tenham sido colonizadas por plantas invasoras, estas devem ser paulatinamente, replantadas com espécies nativas. Áreas extensas de espécies exóticas são mais suscetíveis ao ataque de pragas, que poderão infectar também, as áreas de cultivo.
Manter áreas de refúgio para os polinizadores que podem consistir nas áreas de vegetação nativa ou nas áreas plantadas conforme o primeiro item - estas devem permanecer isentas de pesticidas.
4. Manejo das áreas de cultivo:
Práticas mais agressivas de manejo, como o uso de maquinaria pesada, quando não puderem ser evitadas, devem ser implementadas apenas a cada 2-3 anos, em rotação, e idealmente em apenas 30% da totalidade da área.
As queimadas devem ser evitadas ou então, reduzidas a aplicações a cada 4-6 anos, também em rotação e em até 30% da área total.
Fazer esses manejos preferencialmente, no final do inverno quando muitos dos polinizadores estão menos ativos.