Artigo
Efeitos comparativos de extratos etanólicos de própolis brasileira em células leucêmicas humanas por teste de MTT
Gilberto Carlos Franchi Junior¹, Cleber S. Moraes², Adreas Daugsch², Alexandre Eduardo Nowill1, Yong K. Park ²,*¹ Centro Integrado de Pesquisas Onco-hematológicas da Infância, Universidade Estadual de Campinas, Caixa Postal 6141, 13083-970, Campinas, São Paulo, Brasil.
² Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Caixa Postal 6177, 13083-970, Campinas, São Paulo, Brasil.
* Professor coordenador deste trabalho. Tel.: 19 3521-2157. Fax: 19 3521-2153. E-mail: ykpark@fea.unicamp.br.
INTRODUÇÃO
Própolis é uma resina coletada por abelhas melíferas (Apis mellifera) de exsudatos de árvores, principalmente resinas de botões florais jovens que são misturadas com cera para vedação da colméia e proteger a entrada de intrusos (1). Foi demonstrado que a própolis tem uma gama de atividades biológicas, incluindo atividade antimicrobiana (2), anti-herpes (3), anti-tumoral (4), anti-HIV (5). Devido à variedade de atividades biológicas, recentemente a própolis está sendo adicionada em alimentos e bebidas para melhorar a saúde e prevenir contra doenças (6).
A aplicação médica de própolis tem conduzido ao aumento do interesse pela sua composição química e origem botânica, onde até agora foram encontrados principalmente polifenóis, flavonóides agliconas e seus derivados. A composição química dos principais flavonóides tem demonstrado variações quantitativas dependendo do ambiente vegetal (7,8). Além disso, foram coletadas no Brasil 500 amostras de própolis produzidas por Apis mellifera africanizada, e analisadas. Foram encontrados 12 grupos distintos de própolis baseada na sua composição físico-química. Dentre os 12 grupos de própolis, a própolis de grupo 12, que é conhecida como própolis verde, é a mais utilizada como ingrediente de alimentos funcionais e propósitos farmacêuticos. A origem botânica da própolis do grupo 12 é a resina de botões florais de Baccharis dracunculifolia, encontrados no sudeste brasileiro (7). Foram analisados os efeitos dos extratos etanólicos da própolis do grupo 12 e da resina dos botões florais da sua respectiva origem botânica na antiproliferação de metástase e tumor primário derivado de carcinoma prostático humano e foi observado que em ambas amostras o aumento da inibição foi associado à fase "S" do ciclo celular (9).
Recentemente, foi encontrada uma própolis vermelha em colméias localizadas junto à costa do mar e rios do nordeste brasileiro. Foi observado que as abelhas coletavam o exsudato vermelho da superfície de Dalbergia ecastophyllum (L) Taub. Dessa forma, a própolis junto com o exsudato vermelho foram analisados e ambos apresentaram similaridade entre seus componentes químicos. Consequentemente, a própolis vermelha foi classificada como própolis do grupo 13 (10). Essa pesquisa teve como objetivo investigar os efeitos dos extratos etanólicos das própolis dos grupos 11 e 12 em células leucêmicas humanas.
Materiais e métodos
Linhagem Celular de Leucemia
As seguintes linhagens celular de leucemias foram usadas neste estudo: Leucemia mielóide crônica humana K562, (13) com cromossomo Philadelphia positivo, Leucemia promielocítica aguda HL60 (12), NB4 Leucemia promielocítica aguda (13), Linfoma de Burkitt humano Ramos (14), Linfoma de Burkitt humano Raji (15), Leucemia pró B Nalm16 (16), Leucemia pré B Nalm6 (17), Leucemia B com translocação 4; 11 RS4 (18); Leucemia B com fusão de BCR-ABL B15 (19), células B precursoras de leucemia REH (20). As células foram cultivadas em garrafas plásticas de 25 cm3 à 37oC com umidade de ar de 5% CO2, em meio de cultura de RPMI 1640 (Sigma - D5648) suplementado com 10% de soro bovino fetal (Gibco 1600-044) inativado, 1% de l-glutamina, 50 unidades/ml penicilina, 50 mg/ml estreptomicina
Avaliação de viabilidade celular por corante Tripan blue
Os extratos de própolis e a droga referência foram incubados com K562, Nalm6 e Nalm16. Alíquotas com suspensão de 3x106 células/mL de K562, Nalm6 e Nalm16, foram dispostas em placas de cultura com 6 poços, foram diluídas em meio de cultura, incubadas com 100 µg/mL de própolis G12, G13 e droga citotóxica referencia. Todas as incubações de celulas foram realizadas em placas de cultura de 6 poços (Corning, New York NY) a 37o C com 5% CO2 e sob condições de umidade com volume final de 10 mL. Após os tempos de incubação (24, 48 e 72 horas), foi retirado 1 mL para contar com 0,4% tripam blue (Sigma - T6146) em PBS (Sigma - P4417) filtrado a 0,22 µm em hemocitômetro de newbauer (21).
Análise de apoptose por citometria de fluxo a laser
A avaliação o fenômeno Apoptose foi realizado utilisando-se TACS Annexin V-FITC (kit R&D Systems, Inc. Minneapolis, MN USA) em Citometria de fluxo (22). Células K562 foram resuspensas a 3x106 células/ml em meio de cultura de RPMI 1640. Sob as células foi adicionado o meio de cultura contendo a droga a ser testada até a concentração final de 100 µg/mL em placa de poliestireno de 6 poços a 370C por 1, 3, 6, 12, 24, 48 e 72 horas.
As amostras foram avaliadas no Becton Dickinson FACScanto flow cytometer e os dados analisados usando FacsDiva software program Becton Dickinson Immunocytometry Systems, San Jose, CA. Análises de controle celular corado com Annexin V-FITC e PI somente foi usada para ajuste da compensação da máquina.
Teste de citotoxidade
A atividade citotóxica de cada composto em cada linhagem celular foi determinada por teste de MTT. O sal tetrazolio brometo de 3-(4.5-dimetiltiazol-2-il)-2-5 difenil tetrazolio (MTT) é reduzido pela Dehidrogenase mitocondrial encontrado em células viaveis, a redução transforma o MTT em sal de Formazan. A formação de Formazan fornece uma indicação de integridade da atividade mitocondrial que pode ser interpretada como uma medida de viabilidade (23). As células foram expostas por 48 horas à 7 diferentes concentrações dos própolis testados. Após o período de incubação as placas foram centrifugadas para obter-se o sedimento celular e subsequentemente foi retirado o sobrenadante. Foi adicionado nas células 10 µL MTT (Sigma - M5665) dissolvido em 100 µL PBS e incubado por 4 horas a 37º C com 5% CO2 e em condições úmidas. Após a incubação, as placas foram centrifugadas e o sobrenadante removido, e em seguida, o sal insolúvel de formazan cristalizado foi dissolvido em 150 µL de isopropanol. A absorbância foi registrada em leitor de placa ELISA Synergy-TM (BioTek Instruments, Highland Park - USA) a 570 nm. Os resultados foram convertidos em concentração inibitória (IC50%), concentração de droga suficiente para inibir 50% das células.
Resultados
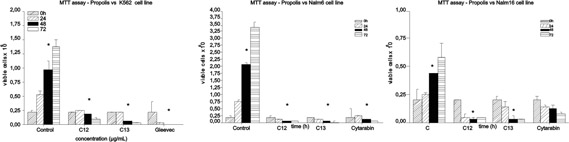
Figura 1: Nos gráficos A, B e C com tripan blue, células foram transferidas para um
hemocitômetro para contagem. Estes gráficos mostram a evolução da morte celular
causada pelo extrato de própolis e pela droga referência para cada célula.
Avaliação de viabilidade celular por corante Tripan blue Na Figura 1A, as amostras de própolis mostraram significante citotoxidade em K562, Nalm6 e Nalm16.
Apoptose
Para verificar a indução da apoptose em K652, Nalm6 and Nalm16, foram utilizados 100 µg/ml de própolis e drogas referência. Como mostrado na Figura 2A, a cultura celular com própolis G13 durante o período, mostrou que em K562, a apoptose alcançou os mesmos níveis que Mesilato de Imatinibe após 48h de incubação, o que não ocorreu com a própolis do G12, contudo, o medicamento referência iniciou precocemente o fenômeno de apoptose. Com Nalm6, própolis G13 e G12 mostraram o mesmo nível de apoptose que o citotóxico Citarabina após 48 horas de incubação. Com Nalm16, foi mostrado que as própolis G12 e G13 em 48 horas induziram mais a apoptose que o citotóxico Citarabina.
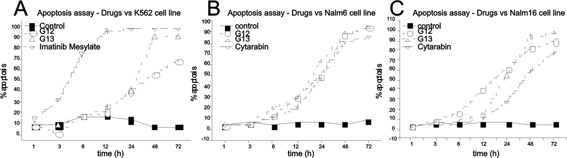
Figura 2: Porcentagem de apoptose celular medida por citometria de fluxo após 1, 3,
6, 12, 24, 48 e 72 horas sobre K562 (A), Nalm6 (B) e Nalm16(C), iniciando relevante
efeito de apoptose em 48 horas de incubação com concentração de
100µg/mL de própolis G12 e G13.
Teste de citotoxidade
A cultura celular foi tratada e mantida com a droga durante 48 horas. A citotoxidade de cada amostra de própolis foi medida através de 6 repetições para cada uma das 12 leucemias testadas. O experimento foi realizado com 7 concentrações em escala logarítmica que variaram de 0,001µg/ml a 1000µg/ml. Pelo método do quadrado mínimo foi obtido pelo método "sigmoidal fit" de 6 medições de IC50. A hipótese da igualdade variável média IC50 (p=<0,003) de cada inibidor foi realizada pelo teste-t aplicado separadamente para cada tipo de leucemia. Os parâmetros estatísticos são apresentados na tabela abaixo e o valor-p encontrado para o teste de diferença de médias em cada leucemia é mostrado na última coluna. A Figura 3 mostra a distribuição de 2 medidas inibitórias de cada substância para cada tipo de leucemia.

Figura 3: Medidas inibitórias (IC50) de cada amostra de própolis para cada tipo de leucemia.
A Tabela 1 indica a diferença entre as médias IC50 das duas substâncias em todas as leucemias e em todos os casos a média de IC50 da própolis G13 foi menor que a média da própolis G12, mostrando que a própolis G13 possui maior citotoxidade para todas as leucemias. Outro relevante aspecto observado e mostrado na Figura 3 é a menor dispersão das medidas de IC50 da própolis G13, indicando menor variação de sensibilidade das células à substância, indicando menor risco de falha no resultado de inibição de uma dosagem suficiente para a inibição da leucemia.
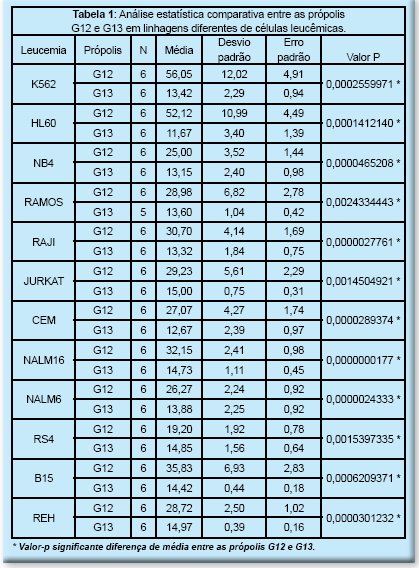
Tabela 1: Análise estatística comparativa entre as própolis
G12 e G13 em linhagens diferentes de células leucêmicas.
Conclusão
Demonstrou-se, nesse trabalho que a própolis G13 é mais citotóxica que a própolis G12. Nosso estudo não tem a pretensão de indicar o própolis G13 para tratamento de Leucemias em humanos. Conclui-se que a própolis G13 é capaz de induzir a apoptose em modelos de leucemias humana após incubação in vitro. Mostrou-se nesses resultados importantes indicações para futuros ensaios pré-clínicos em animais com leucemia e reforça a necessidade de estudos químicos para localizar uma possível substância citotóxica útil presente em própolis G13.
Agradecimentos
Agradecemos o Sr. Edivaldo Pacheco e o Sr. José Alexandre Abreu pela doação das amostras de própolis.
Referências
(1) Greenaway, W.; Scaysbrook, T.; Whatley, F. R. The composition and plant origins of propolis. Bee World. 1990, 71, 107-118.
(2) Ghisalberti, E. L. Propolis: a review. Bee World. 1979, 60, 59-84.
(3) Vynograd, N.; Vynograd, I.; Sosnowski, Z. A comparative multicenter study of the efficacy of propolis, acyclovir and placebo in the treatment of genital herpes (HSV). Phytomedicine. 2000, 7, 1-6.
(4) Park, Y. K.; Koo, M. H.; Abreu, J. A. S.; Ikegaki, M.; Cury, J. A.; Rosalen, P. L. Antimicrobial activity of propolis on oral microorganisms. Curr. Microbiol. 1998, 36, 24-28.
(5) Ito, J.; Chang, F. R.; Wang, H. K.; Park, Y. K.; Ikegaki, M.; Kilgore, N.; Lee, K. H. Anti-AIDS agents. 48. Anti-HIV activity of moronic acid derivatives and the new mellifore-related triterpenoid isolated from Brazilian propolis. J. Nat. Prod. 2001, 64, 1278-1281.
(6) Burdock, G.A. Review of the biological properties and toxicity of bee propolis. Food Chem. Toxicol. 1998, 36, 347-363.
(7) Park, Y. K.; Alencar, S. M.; Aguiar, C. L. Botanical origin and chemical composition of Brazilian propolis. J. Agric. Food Chem. 2002, 50, 2502-2506.
(8) Park, Y. K.; Paredes-Guzman, J. F.; Aguiar, C. L.; Alencar, S. M.; Fujiwara, F. Y. Chemical constituents in Baccharis dracunculifolia as the main botanical origin of Southeastern Brazilian propolis. J. Agric. Food Chem. 2004, 52, 1100-1103.
(9) Li, H; Kapur, A.; Yang, J.X.; Srivastava, S.; McLeod, D.G.; Paredes-Guzman, J.F.; Daugsch, A.; Park, Y.K.; Rhim, J.S. Antiproliferation of human prostate cancer cells by ethanolic extracts of Brazilian propolis and its botanical origin. Int. J. Oncol. 2007, 31, 601-606.
(10) Daugsch, A.; Moraes, C.S.; Fort, P.; Park, Y.K. Brazilian Red Propolis-Chemical Composition and Botanical Origin. Evid. based Compl. Alternative Med. 2008, 5, 435-441.
(11) Gallagher, R.; Collins, S.; Trujillo, J.; McCredie, K.; Ahearn, M.; Tsai, S.; Metzgar, R.; Aulakh, G.; Ting, R.; Ruscetti, F.; Gallo, R. Characterization of the continuous, differentiating myeloid cell line (HL-60) from a patient with acute promyelocytic leukemia. Blood. 1979, 54, 713-733.
(12) Lanotte, M.; Martin-Thouvenin, V.; Najman S.; Balerini P.; Valensi F.; Berger R. NB4, a maturation inducible cell line with t (15;17) marker isolated from a human acute promyelocytic leukemia (M3). Blood. 1991, 77, 1080-1086.
(13) Lozzio, C.B., Lozzio, B.B. Human chronic myelogenous leukemia cell-line with positive Philadelphia chromosome. Blood. 1975, 45, 321-334.
(14) Klein, G.; Giovanella, B.; Westman, A.; Stehlin J.S.; Mumford, D. An EBV-Genome-Negative Cell Line Established from an American Burkitt Lymphoma; Receptor Characteristics. EBV Infectibility and Permanent Conversion into EBV-Positive Sublines by in vitro Infection. Intervirology. 1975, 5, 319-334.
(15) Pulvertaft, R. J. V. Cytology of Burkitt's tumour (African lymphoma). Lancet.i. 1964, 238-240.
(16) Kohno S.; Minowada J.; Sandberg A.A. Chromosome evolution of near-haploid clones in an established human acute lymphoblastic leukemia cell line (NALM-16). J. Natl. Cancer Inst. 1980, 64, 485-493.
(17) Hurwitz R.; Hozier J.; LeBien T.; Minowada J.; Gajl-Peczalska K.; Kubonishi I.; Kersey J. Characterization of a leukemic cell line of the pre-B phenotype. Int. J. Cancer. 1979, 23, 174-180.
(18) Stong, R.C.; Korsmeyer, S.J.; Parkin, J.L.; Arthur, D.C.; Kersey, J.H. Human acute leukemia cell line with the t (4;11) chromosomal rearrangement exhibits B lineage and monocytic characteristics. Blood. 1985, 65, 21-31.
(19) Naumovski, L.; Morgan, R.; Hecht, F.; Link, M.P.; Glader, B.E.; Smith, S.D. Philadelphia chromosome-positive acute lymphoblastic leukemia cell lines without classical breakpoint cluster region rearrangement. Cancer Res. 1988, 48, 2876-2879.
(20) Matsuoa, Y.; Drexler, H.G. Establishment and characterization of human B cell precursor-leukemia cell lines. Leukemia Research. 1998, 22, 567-579.
(21) Freshney, R. Culture of Animal Cells: A Manual of Basic Technique. Alan R. Liss, Inc., New York. 1987, 5th edition.
(22) Vermes, I.; Haanen, C.; Steffens-Nakken, H.; Reutelingsperger, C. A novel assay for apoptosis Flow cytometric detection of phosphatidylserine early apoptotic cells using fluorescein labelled expression on Annexin V. J. Immunol. Meth. 1995, 184, 39-51.
(23) Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods. 1983, 65, 55-63.