Artigo
Própolis Vermelha e sua origem botânica
Daugsch, A.a; Moraes, C.S.a; Fort, P.a; Pacheco, E.; Lima, I.B.b; Abreu, J.A.c; Park, Y.K.a*a Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas - UNICAMP, C.P. 6177, Campinas-SP.
b Universidade Federal de Paraíba - UFPB, João Pessoa-PB.
c Nectar Farmaceutica Ltda., R. Pernambuco 1066, Belo Horizonte-MG.
* Fone: +55-19-3521-2157; Fax: +55-19-3521-2153; E-mail: ykpark@fea.unicamp.br
Resumo
Amostras de própolis vermelha foram coletadas nos manguezais dos estados da Paraíba, Pernambuco, Alagoas, Sergipe e Bahia. As abelhas foram observadas coletando exudato resinoso vermelho de Dalbergia ecastophyllum (L) Taub. (Leguminosae) para produção de própolis. Os flavonóides da própolis e da resina vermelha foram analisados usando os métodos cromatográficos CLAE-FR e CCDAE-FR. Foi concluído que a origem botânica da própolis vermelha é a D. ecastophyllum. Nas áreas onde a D. ecastophyllum é rara ou não está presente, as abelhas coletam de outras plantas. A própolis coletada exclusivamente de D. ecastophyllum tem atividade anti-microbiana maior que a própolis misturada de outras plantas.
Palavras-chaves: Própolis vermelha, origem botânica, Dalbergia ecastophyllum
1) INTRODUÇÃO
Própolis é uma mistura de substâncias resinosas coletada pelas abelhas (Apis mellifera) de várias plantas. Ela é usada pelas abelhas para selar buracos e proteger a colméia (Greenaway et al., 1990; Ghisalberti, 1979). Própolis é usada na medicina popular desde 300 anos antes de Cristo. Numerosas propriedades biológicas tem sido encontradas incluindo citotoxidade (Matsuno et al., 1997), anti-herpes (Vynograd et al., 2000), anti-tumor (Park et al., 1998), anti-HIV (Ito et al., 2001), e efeitos supressivos da toxicidade da dioxina (Park et al., 2005). Devido a extensa gama de atividades biológicas, a própolis é cada vez mais usada como alimento saudável suplementar e em bebidas (Burdock, 1998).
Anteriormente, nós classificamos a própolis brasileira em 12 grupos, baseado nas características físico-químicas, sendo cinco grupos no sul, um no sudeste e seis no nordeste do Brasil (Park et al., 2002). Foi também analisada as origens botânicas das principais própolis. A própolis do grupo 3 foi identificada como sendo resina do botão floral de Populus (Salicaceae). A origem botânica da própolis do grupo 6 e 12 foi identificada sendo resina de folhas jovens de Hyptis divaricata (Lamiaceae) e Baccharis dracunculifolia (Asteracea), respectivamente (Park et al., 2002).
Própolis normalmente é uma resina amarela escura ou amarronzada. Recentemente, nós encontramos uma própolis vermelha em colméias localizadas ao longo do mar e costas de rios no nordeste brasileiro que foi classificada então como própolis do grupo 13. Foi observado que as abelhas coletavam o exudato vermelho da superfície da Dalbergia ecastophyllum (L) Taub. (Donnelly et al., 1973; Matoset al., 1975), assumindo que essa é a origem botânica da própolis vermelha. Então nós analisamos comparativamente as amostras de exudatos das plantas e da própolis vermelha.
2 Materiais e Métodos
2.1 Própolis e sua origem botânica
A própolis vermelha foi coletada de colméias localizadas no caule de arbustos ao longo da praia e costas dos rios na região nordeste do Brasil. O exudato resinoso vermelho secretado pelos buracos feitos por insetos no caule de D. ecastophyllum é mostrado na Figura 1,D. Foi observado que as abelhas visitaram principalmente D. ecastophyllum para coletar resina na superfície dos buracos nos troncos (Figura 1,C). Amostras de exudato vermelho (Figura 1, C e D) foram coletadas para análise e comparadas com amostras coletadas de colméias que estavam localizadas na mesma área. O exudato resinoso foi dissolvido em 80% de etanol. No caso da própolis, aproximadamente 50 g de própolis vermelha foi coletada de uma colméia que estava localizada na mesma área. Nós coletamos cinco amostras iguais de exudato resinoso vermelho e própolis dos cinco estados da região nordeste brasileira e seis amostras de própolis vermelha da mesma área (Alagoas) para examinar a qualidade da própolis.

Figura 1 Coleta de
exudato resinoso
vermelho de D. ecastophyllum
por Apis mellifera.
A = Folhas de D.
ecastophyllum.
B = Sementes de
D. ecastophyllum.
C = Apis mellifera coletando
exudato resinoso
vermelho de D.
ecastophyllum.
Caule de D.
ecastophyllum
com exudato
resinoso vermelho.
2.2 Preparação de extrato etanólico de exudato resinoso vermelho e própolis
500 mg de exudatos resinosos vermelhos foram misturados com 5 mL de etanol a 80 % e a mistura foi agitada por 10 minutos a 70 °C. Depois de centrifugado, o sobrenadante foi analisado.
2.3 Cromatografia em Camada Delgada de Alta Eficiência em Fase Reversa (CCDAE-FR). 3 µL de solução etanólica de própolis e exudato foram cromatografados em placas de sílica gel RP-18F254S por CCDAE-FR, obtido da Merck Co., usando etanol/água (55:45, v/v) como solvente. A detecção dos flavonóides foi realizada usando visualizador UV em 366 nm.
2.4 Cromatografia líquida de alta eficiência em fase reversa (CLAE-FR)
Análises de flavonóides e outros compostos fenólicos de extratos etanólicos de própolis e exudatos resinosos vermelho foram realizadas por CLAE-FR com um cromatógrafo equipado com uma coluna YMC Pack ODS-A (RP-18, coluna de tamanho 4,6 x 250 mm; com partículas de tamanho 5 µm) e detector DAD (SPD-M10A, Shimadzu Co.). A coluna foi eluida usando gradiente linear de água (solvente A) e metanol (solvente B), iniciando com 30% B (0-15 min) e aumentando até 90% B (15-75), parando em 90% B (75-95 min), e diminuindo até 30% B (95-105 min) com um solvente com fluxo de 1 mL/min e detecção com um detector DAD. Os cromatogramas foram realizados a 268 nm. Os padrões autênticos de flavonóides e outros compostos químicos foi obtido da Extrasynthese Co. França.
2.5 Atividade anti-microbiana de extratos etanólicos da própolis e exudatos resinosos
A sensibilidade da própolis ao Staphylococcus aureus ATCC 25923 foi determinada de acordo com o método descrito na referência (Isla et al., 2005). Cultura de S. aureus foi inoculada em placas de ágar nutriente com swabs estéreis, que foram imersos na cultura. Na placa inoculada, foi adicionado discos com extratos de própolis e incubados por toda a noite a 37 °C. Os extratos de própolis e exudatos resinosos foram preparados pela aplicação de 10 µL destes em filtro de papel Whatman no. 3 em discos (5 x 1 mm) e secado a vácuo em temperatura ambiente por toda a noite e depois incubado a 60 ° C por 4 horas.
3 Resultados e discussão
3.1 Própolis e sua origem botânica
A própolis brasileira foi classificada anteriormente em 12 grupos através de suas características. Entre estes 12 grupos de própolis, três grupos (grupo 3, 6 e 12) foram melhor estudados, e foi determinado que as abelhas colheram a resina dos botões florais e as resinas das folhas novas. Recentemente, nós descobrimos a própolis vermelha de colméias que estavam localizadas ao longo da praia e costa das rios no nordeste brasileiro que foi classificada então, como própolis do grupo 13 (Figura 2). Foi observado que as abelhas coletaram exudatos resinosos vermelhos na superfície de D. ecastophyllum para produzir própolis como mostrado na Figura 1,C e D. As amostras de própolis e exudatos resinosos foram analisadas por CLAE-FR e CCDAE-FR. Além disso, 6 amostras de própolis vermelha do estado de Alagoas foram também analisadas para comparação da qualidade química.
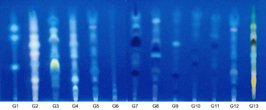
Figura 2 CCDAE-FR dos 13 grupos de
própolis encontrados no Brasil.
3.2 Própolis vermelha e sua origem botânica
CLAE- FR (Figura 3) revelou o perfil cromatográfico de comparação qualitativa e quantitativa de flavonóides e outros constituintes químicos da própolis e exudatos resinosos de D. ecastophyllum. A identificação dos compostos químicos foi realizada pela comparação direta com padrão autêntico e baseada no tempo de retenção, co-cromatografia, e absorção espectrofotométrica. O perfil da Figura 3 e Tabela 1 indicaram que o perfil cromatográfico da própolis é exatamente a mesma que a D. ecastophyllum.
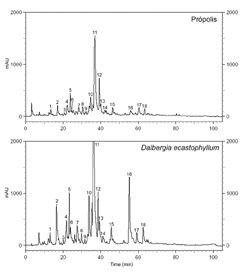
Figura 3 CLAE-FR da própolis vermelha
e de D. ecastophyllum.
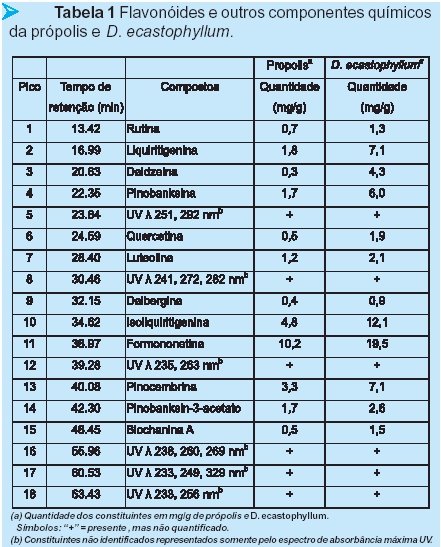
Foi previamente demonstrado que as amostras de extrato de D. ecastophyllum (Leguminosae) da América do Sul, contém os flavonóides liquiritigenina, daidzeína, dalbergina, isoliquiritigenina, formononetina e biochanina A (Donnelly et al., 1973). Foi descoberto que isoliquritigenina inibe o crescimento de câncer prostático (Kanazawa et al., 2003), onde liquiritigenina e isoliquiriigenina inibem a xantina oxidase. A inibição da xantina oxidase foi sugerida para uso no tratamento de hepatites e tumores cerebrais, porque aumentam o nível de xantina oxidase sérica (Kong et al., 2000). Nós também coletamos e examinamos mais 6 amostras de própolis vermelha na mesma região (Alagoas), os resultados estão na Figura 4. CCDAE-FR e CLAE-FR demonstraram que as amostras 2, 3, 4 e 5 mostraram perfis quase idênticos como mostrado na figura 3. Amostras 1 e 6 também mostraram a presença desses compostos, mas quantitativamente em baixa concentração, e mostraram os mesmos picos não identificados que não foram achados no exudato de D. ecastophyllum (tempo de retenção 80-100 min). Nós observamos que as amostras de própolis 1 e 6 foram coletadas de colméias que estavam localizadas em áreas onde D. ecastophyllum era escassa, porém essas abelhas coletaram de outras plantas também.
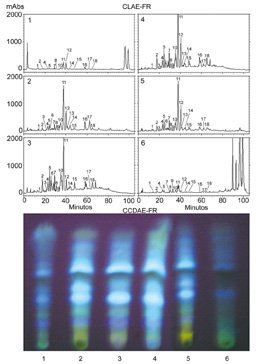
Figura 4 CLAE-FR e CCDAE-FR de
6 amostras de própolis vermelha
da mesma região (Alagoas).
Adicionalmente, a atividade antimicrobiana das 6 amostras de própolis contra Staphylococcus aureus ATCC 25923 foram medidas de acordo com o método descrito na referência (Isla et al., 2005), e os resultados mostrados na Figura 5. Amostras 2,3,4 e 5 demonstraram a mais alta inibição de crescimento bacteriano quando comparado com as amostras 1 e 6, que continham menor concentração de constituintes químicos da D. ecastophyllum, mas contendo também constituintes de outras plantas.
4 Conclusão
Cinco amostras de própolis vermelha de cinco colméias, que estavam localizadas no caule dos arbustos ao longo da praia e costa dos rios do nordeste brasileiro (uma amostra de cada estado) foram analisadas. Foi observado que as abelhas coletavam exudato resinoso vermelho da superfície de D. ecastophyllum para produzir própolis. Todas as amostras e exudatos resinosos mostraram muita similaridade nos perfis cromatográficos de CCDAE-FR e CLAE-FR.
Concluiu-se, que a principal origem botânica da própolis vermelha é a D. ecastophyllum. Amostras de própolis coletadas de colméias em áreas onde D. ecastophyllum é escassa, mostrou menor concentração de constituintes químicos achados na D. ecastophyllum, no entanto outros compostos químicos apareceram (tempo de retenção 80-100 min) que não foram achados em D. ecastophyllum. Conseqüentemente, a própolis demonstrou menor atividade antimicrobiana. Nesse caso as abelhas coletaram a resina de diferentes plantas para produzir a própolis. Sendo assim, a origem botânica da própolis e sua abundância são essenciais para a produção desse tipo de própolis (grupo 13).
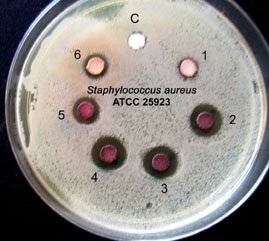
Figura 5 Antibiograma de 6 amostras
encontradas na mesma
região (Alagoas).
Agradecimentos
Uma amostra de Dalbergia ecastophyllum (JPB34951) é mantida no herbário da UFPB (Universidade Federal da Paraíba). Agradecemos ao auxílio da CAPES e CNPq.
Referências
Basnet, P.; Matsuno, T.; Neidlein, R. Z., 1997. Potent free radical scavenging activity of Propol isolated from Brazilian propolis. Z. Naturforsch. 52c, 828-833.
Ghisalberti, E. L., 1979. Propolis: a review. Bee World 60, 59-84.
Burdock, G.A., 1998. Review of the biological properties and toxicity of bee propolis. Food Chem. Toxicol. 36, 347-363.
Donnelly, D. M. X.; Keenan, P. J.; Prendergast, J. P. 1973. Isoflavonoids of Dalbergia ecastophyllum. Phytochemistry 12, 1157-1161.
Greenaway, W.; Scaysbrook, T.; Whatley, F. R., 1990. The composition and plant origins of propolis. Bee World 71, 107-118.
Isla, M. I.; Paredes-Guzman, J. F.; Nieva-Moreno, M. I.; Koo, H.; Park, Y. K., 2005. Some chemical composition and biological activity of Northern Argentine propolis. J. Agric. Food Chem. 53, 1166-1172.
Ito, J.; Chang, F. R.; Wang, H. K.; Park, Y. K.; Ikegaki, M.; Kilgore, N.; Lee, K. H., 2001. Anti-AIDS agents. 48. Anti-HIV activity of moronic acid derivatives and the new mellifore-related triterpenoid isolated from Brazilian propolis. J. Nat. Prod. 64, 1278-1281.
Kanazawa, M.; Satomi, Y.; Mizutani, Y.; Ukimura, O; Kawauchi, A.; Sakai, T.; Baba, M.; Okuyama, T., 2003. Isoliquiritigenin inhibits the growth of prostate cancer. European Urology 43, 580-586.
Kimoto, T.; Arai, S.; Kohguchi, M.; Nomura, Y.; Micallef, M. J.; Kurimoto, M.; Mito, K., 1998. Apoptosis and suppression of tumor growth by artepillin C extracted from Brazilian propolis. Cancer Detect. Prev. 22, 506-515.
Kong, L. D.; Zhang, Y.; Pan, X.; Tan, R. X.; Cheng, C. H. K., 2000. Inhibition of xanthine oxidase by liquiritigenin and isoliquiritigenin isolated from Sinofranchetia chinensis. CMLS, Cell. Mol. Life Sci. 57, 500-505.
Matos, F. J. A.; Gottlieb, O. R.; Andrade, C. H. S., 1975. Flavonoids from D. ecastophyllum. Phytochemistry 14, 825-826.
Matsuno, T.; Matsumoto, Y.; Saito, N.; Morikawa, J., 1997. Isolation and characterization of cytotoxic diterpenoid isomers from propolis. Z. Naturforsch. 52c, 702-704.
Park, Y. K.; Koo, M. H.; Abreu, J. A. S.; Ikegaki, M.; Cury, J. A.; Rosalen, P. L., 1998. Antimicrobial activity of propolis on oral microorganisms. Curr. Microbiol. 36, 24-28.
Park, Y. K.; Alencar, S. M.; Aguiar, C. L., 2002. Botanical origin and chemical composition of Brazilian propolis. J. Agric. Food Chem. 50, 2502-2506.
Park, Y. K.; Paredes-Guzman, J. F.; Aguiar, C. L.; Alencar, S. M.; Fujiwara, F. Y., 2004. Chemical constituents in Baccharis dracunculifolia as the main botanical origin of Southeastern Brazilian propolis. J. Agric. Food Chem. 52, 1100-1103.
Park, Y. K.; Fukuda, I.; Ashida, H.; Nishiumi, S.; Yoshida, K.; Daugsch, A.; Sato, H. H.; Pastore, G. M., 2005. Suppressive effects of ethanolic extracts from propolis and its main botanical origin on dioxin toxicity. J. Agric. Food Chem. 53, 10306-10309.
Vynograd, N.; Vynograd, I.; Sosnowski, Z., 2000. A comparative multicenter study of the efficacy of propolis, acyclovir and placebo in the treatment of genital herpes (HSV). Phytomedicine 7, 1-6.