Artigo
ANÁLISE DA INFLUÊNCIA DE AGENTES SOLUBILIZANTES NA ATIVIDADE ANTIMICROBIANA DE EXTRATOS DE PRÓPOLIS E DE UMA FORMULAÇÃO DE SPRAY HIDROALCOÓLICO.
SUSSUMU KONISHI 1, ALEXANDRA CHRISTINE HELENA FRANKLAND
SAWAYA 1, ANGELA RAMALHO CUSTÓDIO2, ILDENISE BARBOSA DA SILVA
CUNHA
1, MARIO TSUNEZI SHIMIZU 1
Centro de Ciências Biológicas e da Saúde, USF/
Bragança
Paulista.
Naturalabor - Análise e Pesquisa Ltda, Campinas.
e-mail : shimizu@saofrancisco.edu.br
1. INTRODUÇÃO
A própolis é uma resina extraída das árvores pelas abelhas que as enriquecem com enzimas existentes em sua saliva (MARCUCCI, 1995). As abelhas usam esta substancia para proteger as colméias contra insetos e microorganismos, empregando-a no reparo de frestas ou danos à colmeia1 no preparo de locais assépticos para a postura da abelha rainha e na mumificação de insetos invasores (MARCUCCI, 1994; MARCUCCI, et al. 1998).
A própolis possui uma composição complexa e varia de região para região, dependendo da vegetação local; é composto de 55% de resinas e bálsamos, 30% de ceras, 10% de voláteis e 5% de pólen. Na própolis existem numerosos compostos fenólicos; na própolis européia predominam os flavonóides e na brasileira são mais abundantes os ácidos fenólicos (GRANGE E DAVEY, 1990). Talvez seja esse um dos fatores da preferência do mercado internacional em relação aa própolis produzida no Brasil. Entre os compostos fenólicos, temos os ácidos p-cumárico, caféico, ferulico e ésteres destes ácidos ( MATSUSHIGE, et al, 1996; TAKAISIS-KIKUMI E SCHICHER, 1994). A literatura descreve varies estudos sobre a ação farmacológica da própolis (MARCUCCI, 1995). A própolis bruta encontra-se no estado sólido. A cor e o odor podem variar; o ponto de fusão varia de 60 a 700C; apresenta-se dura a 150C e maleável a partir dos 300C. Por ser uma resina, não é solúvel em água, mas alguns solventes orgânicos como etanol, propilenoglicol, clorofórmio, éter, tolueno, tricloroetileno e acetona, permitem a dissolução de alguns dos seus constituintes (MALLINKRODT-BAKER; MARCUCCI, 1995 ).
A baixa solubilidade da própolis em água limita o seu uso nas preparações de formas farmacêuticas, principalmente líquidas. No mercado, a maioria dos extratos e tinturas disponíveis são produzidas a base de álcool, que pode provocar reações adversas e contra indicações (BANKOVA, et al., 1996) Pela complexa composição química, dificilmente encontrar-se-á um solvente que extraia todos seus princípios ativos, devido as diferentes polaridades das moléculas. Por outro lado, a adição de um tensoativo ou qualquer outra substancia com uma extremidade polar e a outra formada por uma cadeia parafínica longa, pode diminuir a tensão interfacial entre as substancias presentes na própolis e o meio (MAGRO e CARVALHO, 1990 ) ajudando a soIubilizá-las.
Portanto, aliando estas informações ao fato que há uma grande valorização comercial do extrato aquoso de própolis, principalmente para uso por via oral, foram estudados cinco extratos obtidos com diferentes solventes. Em quatro deles substituiu-se 50% do álcool etílico por água e agentes solubilizantes ou por solventes orgânicos normalmente usados nas industrias farmacêuticas. Os objetivos deste trabalho foram:
-Avaliar o efeito dos solventes (e dos agentes solubilizantes) na preparação dos extratos de própolis.
-Preparar uma formulação em spray contendo estes extratos.
-Analisar a atividade microbiana dos extratos e formulações.
2. MATERIAL E MÉTODOS
2.1. EXTRATOS
A própolis bruta foi adquirida do Apiário Peçanha, em Atibaia, SP em 2000. A vegetação predominante era mata nativa com plantações de eucalipto, rosas e crisântemos. Os cinco solventes extratores utilizados foram:
A. Álcool etílico P. A. (para análise)
B. Álcool etílico P. A. + Água deionizada (1:1, v:v) + Polissorbato 80 a 0,5% (p/v).
C. Álcool etílico P. A. +Água deionizada (1:1, v:v) + Laurilsulfato de sódio a 0,1% (p/v).
D. Álcool etílico P. A. + propilenoglicol (1:1, v:v)
E. Álcool etílico P. A. + polietilenoglicol 400 (1:1, v:v)
Em 100 ml de cada solvente foram colocadas 30 g da própolis previamente moída. A extração por feita por maceração por 15 dias a 40ºC. Após este período, as soluções foram filtradas e guardadas em freezer a –15 ºC por uma noite, em seguida foram novamente filtradas a esta temperatura para retirar as ceras.
2.2. FORMULAÇÃO PARA SPRAY COM MEL
Os extratos assim obtidos foram
incorporados na seguinte formulação:
| Extrato de própolis | 50,00 ml |
| Mel | 30,00 g |
| Metilparabeno | 0,10 g |
| Propilparabeno | 0,02 g |
| Vanilina | 0,03 g |
| Álcool P. A. | 1,00 ml |
| Glicerina | 5,00 g |
| Sacarina | 0,05 g |
| Ciclamato de sódio | 0,05 g |
| Mentol | 0,05 g |
| Água deionizada qsp | 100,00 ml |
2.3. AVALIAÇÃO DO RENDIMENTO E COMPOSIÇÃO DOS EXTRATOS.
Os extratos tiveram seus solventes evaporados em estufa a 40 º C, para obter o rendimento da extração, com exceção do extrato D, obtido com propilenoglicol, que não evapora a esta temperatura.
Os extratos de própolis foram submetidos a cromatografia de camada delgada (CCD). As placas foram preparadas no laboratório de pesquisa da Universidade São Francisco, usando placas de vidro e sílica gel Merck 60 GF254. Estas compõem a fase estacionaria da cromatografia; as fases móveis utilizadas foram: hexano puro, misturas de hexano com acetato de etila em três proporções diferentes (7:3, 5:5 e 3:7 v:v) e acetato de etila pura. Cerca de 5mL dos extratos de própolis foram colocados a 1,5 cm da borda inferior das placas, o que equivale a 500 mg de extrato de própolis por ponto. Padrões de rutina, quercetina, ac. p-cumárico e ac. trimetilcumárico também foram colocadas nas placas. Os cromatogramas foram desenvolvidos no sentido vertical ascendente por uma distancia de 10 cm. Após o desenvolvimento, as placas foram secas e analisadas em luz ultravioleta e em seguida foram reveladas com FeCI3 a 2% em etanol (COSTA, 1987). Este reagente revela a presença de flavonóides e compostos fenólicos.
2.4. AVALIAÇÃO DA ATIVIDADE POR TESTES MICROBIOLÓGICOS
A avaliação da atividade antimicrobiana dos extratos e das formulações foi feita frente aos seguintes microorganismos freqüentemente encontrados na cavidade bucal:
Staphylococcus aureus ....3 cepas
Streptococcus mutans........2 cepas
Candida albicans.................2 cepas
Os microorganismos foram repicados em tubos inclinados contendo o meio de cultura “Antibiotic agar medium 1” (Difco) para as bactérias e Agar Sabouraud Dextrose (Merck) para as leveduras, incubados a 37°. C por 24 a 48 horas. Após o crescimento, cada microorganismo foi suspenso em 10 ml de solução salina até uma concentração de aproximadamente 5 x 108 UFC, por comparação com o tubo n0 1 da escala de MacFarland em espectrofotômetro a 430 nm.
Cerca de 100 ml das suspensões de microrganismos foram colocados em placas de Petri contendo 20 ml dos meios de cultura acima, previamente esterilizados e resfriados a aproximadamente 45-50°C.
Para a avaliação da atividade antimicrobiana foi utilizado o método de difusão em placas. Foram utilizados discos de papel impregnados com 10mL dos extratos de própolis e/ou das formulações, cujos solventes foram a seguir evaporados em fluxo laminar. Como controle dos extratos e formulações foram preparados discos impregnados de soluções contendo todos os componentes, menos a própolis, que foram também secos em fluxo laminar. Os discos de papel impregnados foram colocados em pontos eqüidistantes da superfície do meio de cultura.
Para os extratos D e E , bem como suas formulações, que não evaporavam no disco de papel, foram usados discos de aço inox (templates) em cujos orifícios foram colocados 10mL dos extratos, formulações e respectivos controles. Os mesmos foram previamente esterilizados e colocados assepticamente na superfície do meio de cultura.
Todas as placas foram incubadas em estufa a 37° C por 24 horas (para as bactérias) e 48 (para as leveduras). Após este período foi medido o diâmetro dos halos de inibição de crescimento.
3. RESULTADOS E DISCUSSÃO
3.1. RENDIMENTO E COMPOSIÇÃO DOS EXTRATOS.
O rendimento das extrações pode ser observado na tabela 1. O valor do extrato D não pode ser obtido diretamente, pois não evaporou a temperatura ambiente, mas foi estimado indiretamente por diferença entre as massas inicial e final das soluções. Neste estudo, rnodificou-se a solubilidade da própolis durante a extração, aumentando-se a temperatura do solvente para 40 ºC e substituindo-se parte do álcool por outros solventes. Obteve-se para todas as cinco extrações urn rendimento de 20 a 30%, que esta de acordo com a literatura (PRADO FILHO, et al., 1962). O solvente extrator de maior rendimento foi o álcool etílico, como já era esperado. A substituição de 50% do álcool pela água, com pequena quantidade de tensoativos, foi interessante, pois apesar dos componentes da própolis serem praticamente insolúveis em água, o rendimento dos extratos B e C foram próximos ao do etanol puro (A), demonstrando a eficiência dos tensoativos. A substituição de 50% do álcool pelos solventes propilenoglicol (D) ou polietilenoglicol (E) também proporcionou um rendimento que se compara ao da extração com etanol puro.
Tanto o polissorbato quanto o laurilsulfato de sódio são bons agentes emulsivos do tipo óleo/água (HELOU, et al., 1975). O propilenoglicol é um bom solvente, dissolve muitos óleos essenciais. O polietilenoglicol 400 (também conhecido corno PEG, polietilenoglicol ou carbowax 400) é solúvel em água e em muitos solventes orgânicos (MALLINKRODT-BAKER) É importante frisar que, se calcularmos uma dosagem diária com 5 aplicações de 2 ml de spray, as quantidades utilizadas destas substâncias não devem causar danos ou perigo para a saúde humana, sendo solventes e tensoativos normalmente encontrados em formulações farmacêuticas (MALLINKRODT-BAKER ).

Rendimento das extrações de própolis
*valor obtido por estimativa
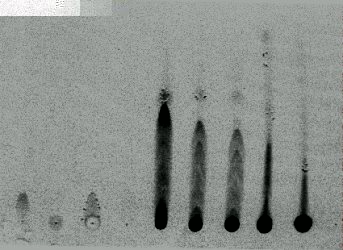
Figura 1. Cromatografia em camada delgada dos padrões:
1. Quercetina; 2. Rutina; 3. ácido p-cumárico;
4. ácido trimetilcumárico; e os extratos obtidos com :
A. álcool etílico P. A.; B. álcool etílico +
água deionizada (1:1, v/v) + polissorbato 80
a 0,5% (p/v); C. álcool etílico PA. + água deionizada
(1:1, v/v) + laurilsulfato de sódio a 0,1% (p/v),
D álcool etílico P. A. + propilenoglicol (1:1, v/v);
E. álcool etílico P. A. + polietilenoglicol 400 (1:1,v/v).
Fase móvel: hexano e acetato de etila 1:1.
Revelador FeCl3 a 2% em etanol.
Os resultados das avaliações da atividade antimicrobiana dos extratos e suas formulações são apresentados na Fig. 2 e representam a média dos testes realizados em duplicata. As formulações contendo propilenoglicol (D) e polietilenoglicol 400 (E) na sua composição, não puderam ser avaliadas pelo método usado, pois as bordas dos halos de inibição eram irregulares e pouco nítidas, impossibilitando que fossem medidas.
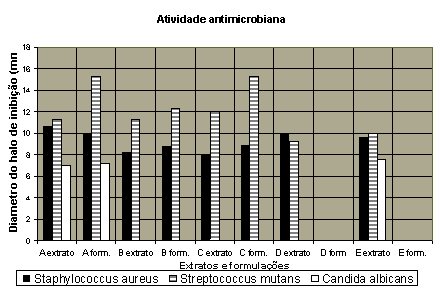
Figura 2. Atividade antimicrobiana dos extratos de própolis
(A, B, C, D e E) e suas respectivas formulações,
avaliada pelo método de difusão em agar.
* Sem leitura de halo por interferência dos
componentes da formulação.
Já frente a Candida albicans, somente o extrato alcoólico A, sua formulação e o extrato E mostraram atividade inibitória. Isto confirma a menor sensibilidade deste gênero frente aos componentes da própolis.
As formulações farmacêuticas líquidas a base de própolis foram preparadas em forma de spray oral para serem aplicados na boca e garganta com o intuito de evitar infecções da boca e garganta como piorréia, estomatites, faringites e laringites, o que determinou a escolha dos tipos de rnicroorganismos no teste de atividade.
Não foi encontrado na literatura, trabalho utilizando os diversos solventes extratores utilizados no presente trabalho e cujos resultados pudessem ser comparados com os nossos. Os resultados da atividade dos diferentes extratos foram comparados com o extrato com álcool etílico P. A., considerado aqui corno referencia, pelo fato da rnaioria dos trabalhos utilizarem este solvente e também por ser um dos que melhor extrai os componentes da própolis. Brumfit et al. ,(1990) utilizou discos de papel impregnados com 20 ml de extrato de própolis, obtendo halos de inibição frente a S. aureus e C. albicans de 7 a 14 mm.
Lembramos ainda que a solubilidade das amostras afeta de sobremaneira os resultados pelo método de difusão em placas, o que pode explicar os diâmetros dos halos de inibição obtidos pelos extratos obtidos usando 50% de água e tensoativos, que facilitam a sua difusão no agar.
4. CONCLUSÕES
Todos os solventes utilizados foram eficientes em extrair princípios ativos, principalmente os compostos polares, presentes na própolis.
Os microorganismos, Staphylococcus aureus e Streptococcus mutans, foram sensíveis a todos os extratos de própolis e suas formulações; demonstrando que todos estes extratos podem ser usados em formulações para uso oral contra estes microorganismos.
Poucos extratos e somente uma formulação foram eficientes contra Candida albicans.
5. REFERÊNCIAS BIBLIOGRÁFICAS
BANKOVA, V. S., et al., Antibacterial diterpenic acidas in Brazilian Propolis. Zeit. Naturforsch., 51 c (5-5): 227-280, 1996.BRUMFIT, W., J. M. T., FRANKLIN, I. Antibiotic activity of natural products: 1. Propolis. Micróbios, (62): 19-22, 1990.
COSTA, A. F., Farmacognosia. 3a. .ed. Lisboa: Fundação Calouste Gulbenkian, p. 195-225, 1987.
GRANGE, J. M., DAVEY, R. W. Antibacterial propoerties of propolis (bee glue). J. R. Soc. Med., (83-3): 107-118, 1990.
HELOU, J. H., et al., Farmacotécnica. 1a. ed, p. 254-270, 1975.
MAGRO-FILHO, O., CARVALHO, A. C. P. Aplication of propolis to dental sockets and skin wounds, J. Nihon Univ. Sch. Dent., (36-2): 4-13, 1990.
Mallinkrodt Baker, Inc. 222 Red School Lane, Phillipsburg, N. J. 08865, USA, Revista.
MARCUCCI, M. C. Propolis: Chemical composition, biological properties and therapeutic activity. Apidologie, v. 26, p. 83-99, 1995.
MARCUCCI, M. C. Propolis (Bee Glue): Uses in Cosmetic and Pharmaceutical Industry. Revista Farm. E Bioquim. USP. (30):26-31, 1994.
MARCUCCI, M. C., RODRIGUEZ, J., FERRERES, F., et. al. Chemical composition o Brazilian propolis from São Paulo State. Zeit. Naturforsch., 53 C, p. 117-9, 1998.
MATSUSHIGE, K., et al., Potent antihepatotoxic activity of dicaffeoylquinic acids from propolis. Biol. Pharm. Bull., (19-4):655-657, 1996.
PRADO FILHO, L. G., et al., Antimicrobianos em própolis de Apis mellifera. Bol ind. Anim. (20):399-403, 1962.
TAKAISI-KIKUNI, N. B., SCHILCHER, H. Electron-microscopic and Microcalorimetric Investigations of the Possible Mechanism of the Antibacterial Action of a Defined Propolis Provenance. Planta Med.,(60-3):222-227, 1994.