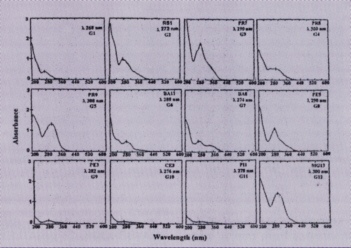
Figura 2 - RP-HTPLC dos extratos etanólicos de
própolis
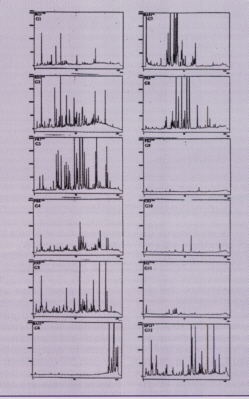
Fig.3: Cromatografia líquida de alta eficiência
dos extratos etanólicos de própolis
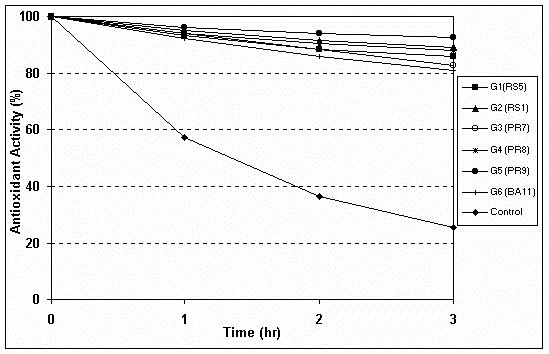
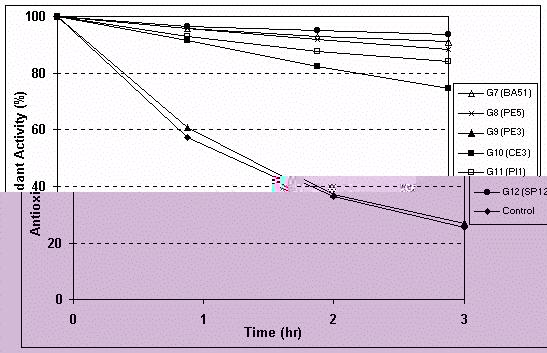
Figura 4: Atividade antioxidante dos extratos etanólicos
de própolis.
CLASSIFICAÇÃO DAS PRÓPOLIS BRASILEIRA A PARTIR DE SUAS CARACTERÍSTICAS FISICO-QUÍMICAS E PROPRIEDADES BIOLÓGICAS
Yong Kun Park; Masaharu Ikegaki & Severino Matias de Alencar Universidade Estadual de Campinas – UNICAMP, Faculdade de Engenharia de Alimentos, Caixa Postal 6177, CEP 13081-970, Campinas – SP, Fone: 55-19-788-7055, Fax: 55-19-289-2832
1- INTRODUÇÃO
Própolis é uma resina produzida pelas abelhas, misturando-se substâncias coletadas de diferentes partes das plantas, como brotos, botões florais e exudados resinosos, com as secreções produzidas em seu organismo, dando origem a um material de coloração e consistência variada, utilizada para fechar pequenas frestas, embalsamar insetos mortos no interior da colméia e proteger contra a invasão de insetos e microrganismos (Ghisalberti, 1979). Em países de clima temperado da Europa e América do Norte, os vegetais produtores de própolis são poucos. O choupo, Populus L., da família Salicaceae é a principal fonte. Ainda pode-se encontrar esta espécie vegetal na Ásia e no norte da África. Entretanto, não é natural dos trópicos. No Brasil, existem diversas espécies vegetais para a retirada de resina. No entanto, poucas foram as espécies identificadas até agora, mas o assa-peixe, aroeira, alecrim e eucalipto são alguns exemplos de vegetais onde as abelhas buscam a matéria-prima para a produção da própolis. Os efeitos terapêuticos têm sido atribuídos aos diversos compostos fenólicos que compõe a própolis e que estão largamente distribuídos no reino vegetal. Destes, os flavonóides podem ser considerados os principais compostos, encontrando-se ainda, alguns ácidos fenólicos e seus ésteres, aldeídos fenólicos, álcoois e cetonas (Bankova et al., 1983; Bankova et al., 1992). Fatores como a ecologia vegetal da região onde a própolis foi coletada (Park et al., 1995; Park et al., 1997) e até mesmo a variabilidade genética das rainhas (Koo & Park, 1997), também influenciam na composição química da própolis.
Dentre os produtos apícolas tais como mel, geléia real, pólen, entre outros, a própolis vem se destacando tanto pelas suas propriedades terapêuticas, como atividade antimicrobiana, antiinflamatória, cicatrizante, anestésica (Ghisalberti, 1979; Bankova et al., 1989; Greenway et al., 1990) e anticariogênica (Park et al., 1998a; Park et al., 1998b; Koo et al., 1999; Koo et al., 2000a; Koo et al, 2000b; Koo et al, 2000c), quanto pela possibilidade de aplicação na indústria farmacêutica e alimentícia. Atualmente existem diversos produtos contendo própolis comercializados em todo mundo, principalmente no Japão, tais como balas, chocolates, doces, xampus, cremes para pele, soluções anti-sépticas, pastas de dente, etc (Ackermann, 1991).
O objetivo deste trabalho foi classificar as amostras de própolis coletadas de todas as regiões do Brasil (exceto região norte) e avaliá-las de acordo com alguns métodos físico-químicos e, posteriormente, determinar algumas de suas propriedades biológicas. Na edição anterior desta Revista (Mensagem Doce, n° 56, maio de 2000) está publicado um artigo com dados referentes à atividade citotóxica e anti-HIV das própolis brasileiras.
2-METODOLOGIA
2.1- Determinação das características físico-químicas
Os extratos etanólicos de própolis (EEP) foram preparados como descrito por PARK & IKEGAKI (1998). Após a extração, a mistura foi centrifugada e o sobrenadante utilizado para a realização dos diferentes estudos.
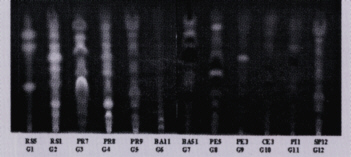
Entre as análises realizadas para a classificação dos diferentes tipos de própolis, uma das mais importantes é a cromatografia em camada delgada de alta eficiência (CCDAE) na qual, após o desenvolvimento em sistema de solvente adequado, é possível observar os diferentes perfis da composição química da própolis e, dessa forma, classificá-la em diferentes grupos. Além dessa técnica, foi também utilizada a metodologia onde se determinou o espectro de absorção em luz ultravioleta, na qual, cada tipo de própolis apresenta uma curva de absorção característica nessa faixa de comprimento de onda e a cromatografia líquida de alta eficiência (CLAE) na tentativa de identificar alguns dos compostos existentes na própolis.
Para realização da cromatografia em camada delgada de alta eficiência (CCDAE), alíquotas de 3 µlL dos respectivos extratos foram aplicados em cromatoplacas (10 x 10 cm) RP-18 F254-S (Merck Co.). O tempo de desenvolvimento do cromatograma foi de 100 minutos aproximadamente, utilizando como sistema de solvente etanol 95%:água destilada (55:45, v/v). Após o término do desenvolvimento da corrida, as placas foram observadas sob luz ultravioleta nos comprimentos de onda de 254 e 366 nm, utilizando iluminador U.V. Cole Parmer, modelo UVP-UVGL-58.
Para a determinação do espectro de absorção dos extratos etanólicos de própolis, alíquotas de 25 µl do extrato foram diluídas em 30 ml de etanol 95% e o espectro de absorção na região U.V. das amostras foi determinado na faixa de comprimento de onda entre 200 a 600 nm (“U.V. scanning”) utilizando espectrofotômetro Beckman DU-70.
A cromatografia líquida de alta eficiência foi realizada utilizando cromatógrafo líquido Shimadzu modelo LC-10 equipado com coluna de fase reversa e acoplado ao detector de arranjo de diiodo. A fase móvel utilizada foi uma mistura de metanol, água e ácido acético em um sistema de gradiente. Para identificação dos compostos foram utilizados padrões autênticos fornecido pela Extrasynthese A.A. Co., França.
2.2- Determinação das propriedades biológicas
Teste da atividade antimicrobiana dos extratos etanólicos de própolis em bactérias patogênicas
Nos discos de papel de filtro Whatman n° 3 (5 x 1mm de diâmetro) foram aplicados 10 µL dos respectivos extratos de própolis e então colocados em dessecador com sílica à temperatura ambiente por 24 horas. Posteriormente, foram mantidos na estufa a 60°C por 2 horas para eliminação de qualquer resíduo etanólico. A análise da atividade antimicrobiana dos extratos de própolis na bactéria gram positiva Staphylococcus aureus coagulase positiva foi realizada de acordo com o método descrito por BLAIR et al. Culturas ativas de S. aureus foram inoculadas por espalhamento com “swabs” estéreis em placas de Petri contendo ágar nutriente. Os discos com os extratos foram colocados sobre as placas inoculadas e incubadas a 37oC por 24 horas. A atividade antimicrobiana foi determinada pela formação de halo inibitório ao redor dos discos.
Os mesmo discos foram utilizados para testar a atividade antimicrobiana dos extratos etanólicos sobre a bactéria Streptococcus mutans. Neste caso, as placas contendo o microrganismo inoculado foram incubadas em jarras de anaerobiose por 24 horas a 37oC.
Determinação da atividade antioxidante dos extratos etanólicos de própolis
A atividade antioxidante foi determinada pela oxidação acoplada do ß-caroteno e do ácido linoléico como descrito nas referências (Hammerschimidt & Pratt, 1978; Pratt & Birac, 1979; Pratt & Watts, 1979). Segundo esse método, a própolis agiria como o agente antioxidante, protegendo o ß-caroteno de sofrer oxidação causada pelos radicais formados a partir da oxidação do ácido linoléico.
Determinação da inibição da atividade da hialuronidase pelos extratos etanólicos de própolis
A inibição da atividade de hialuronidase foi determinada conforme descrito nas referências (Reissing et al., 1955) e (Aronson & Davidson, 1967). A partir dessa metodologia, a própolis agiria sobre a enzima hialuronidase, inibindo a sua atividade sobre o substrato, conhecido como ácido hialurônico. Essa enzima é responsável por vários processos inflamatório, sendo que, se um determinado composto é capaz de inibir sua atividade, tem grande potencial para ser utilizado como substância antiinflamatória.
3- RESUSLTADOS E DISCUSSÃO
Análise dos extratos etanólicos de própolis
Foram coletadas ao todo 500 amostras de própolis de diferentes regiões do Brasil. Após o processamento e analise dessas amostras quanto a aparência e coloração dos extratos, o espectro de absorção na região do UV-visível e o perfil da CCDAE e CLAE foi possível classificar 12 grupos distintos de própolis, estando os resultados apresentados na Tabela 1, Figuras 1, 2 e 3. Como demonstrado na Tabela 1, cinco grupos de própolis foram encontrados na região sul, seis grupos na região nordeste e um grupo na região sudeste. Esse resultado sugere que existe uma maior diversidade de própolis nas regiões sul e nordeste do Brasil na mesma proporção que a vegetação destas regiões também variam. Neste estudo foram observados outros tipos de própolis que apareceram com menor freqüência, cujas mesmas foram coletadas em ambientes com vegetação muito particular, e que não apresentaram propriedades biológicas sendo que, desta forma, não foram incluídos nesta classificação. Com relação aos sólidos solúveis em etanol, a maioria das amostras apresentou resultados na faixa de 41,3% a 63,0%, exceto duas amostras (Grupos 10 e 11) que apresentaram valores de 24,1% e 23,1%. Analisando as Figuras 1, 2 e 3 foi possível observar as diferenças entre os grupos e através da CCDAE e CLAE (Figuras 2 e 3) verificou-se que existem composições químicas totalmente diferentes uns dos outros como, por exemplo, quando se compara as amostra do grupo 1, 3, 6 e 12. Através dos estudos das propriedades biológicas, verificou-se que essas própolis apresentaram os melhores resultados, ilustrados a seguir.
Atividade antimicrobiana dos extratos etanólicos de própolis
A atividade antimicrobiana de todos os grupos selecionados foi realizada utilizando os microrganismos patogênicos Staphylococcus aureus e Streptococcus mutans. Os resultados estão apresentados na Tabela 2. Com relação à atividade sobre Staphylococcus aureus, observamos que a própolis do grupo 1 não inibiu o crescimento microbiano e as própolis dos grupos 2, 9, 10 e 11 inibiram de forma bastante fraca. Porém, as própolis dos grupos 3, 4, 5, 8 e 12 inibiram moderadamente enquanto que as própolis dos grupos 6 e 7 inibiram fortemente o crescimento da bactéria Staphylococcus aureus. Já com relação ao microrganismo Streptococcus mutans, a própolis do grupo 6 apresentou a maior atividade antimicrobiana, seguida da própolis do grupo 3, que apresentou atividade moderada. As demais amostras apresentaram inibição mínima ou não apresentaram atividade antimicrobiana contra este microrganismo.
Atividade antioxidante e antiinflamatório
Os resultados da atividade antioxidante dos extratos etanólicos de própolis estão ilustradas na Figura 4. Os resultados indicam que todos os grupos classificados apresentaram excelente atividade antioxidante, acima de 80%, exceto a amostra do grupo 10 que apresentou atividade menor que 80% e a própolis do grupo 9 que não apresentou atividade antioxidante. Com relação à atividade antiinflamatória, ou seja, a inibição da enzima hialuronidase, as amostras dos grupos 3, 5, 6, 7, 8 e 12 foram as que apresentaram maior atividade quando comparadas com os grupos 1, 2, 4, 9, 10 e 11 (Tabela 3).
4- CONCLUSÃO
De acordo com os resultados obtidos, podemos concluir que existe uma grande diversidade de própolis dentro do território brasileiro, que pode ser explicado pelos diferentes biomas existentes nas regiões onde foram coletadas as amostras de própolis. Observamos ainda que as propriedades biológicas dependem do tipo da própolis testada, levando a concluir que existem tipos específicos de própolis para cada caso, por exemplo, a própolis que tem atividade antimicrobiana contra Staphylococcus aureus (Grupo 12) não atua da mesma forma sobre Streptococcus mutans, sendo que uma outra própolis (Grupo 3) age muito bem contra esse último porém com atividade menor contra Staphylococcus aureus. Ou ainda, própolis dos grupos 1, 9, 10 ou 11 praticamente não possui atividade antimicrobiana contra os microrganismos testados. Com relação à atividade antioxidante, já era esperado que a própolis tivesse boa atividade já que a composição básica desse produto é formada de compostos fenólicos, compostos estes bastante estudados para esta finalidade.
Portanto, existe a necessidade de realizar um controle mais rigoroso com relação à qualidade das própolis comercializadas no Brasil e ainda, um maior aprofundamento nos estudos sobre as propriedades biológicas e também a identificação dos eventuais compostos responsáveis por essas atividades biológicas.
5-REFERÊNCIAS BIBLIOGRÁFICAS
ACKERMANN, T. Fast chromatography study of propolis crudes. Food Chem., v.42, p.135-138, 1991.
ARONSON, N.N.; DAVIDSON, E.A. Lysossomal hyaluronidase from rat liver. J. Biol. Chem., v.242, p.437-440, 1967.
BANKOVA, V.; CHRISTOV, R.; STOEV, G.; POPOV, J. Determination of fenolic from propolis by capillary gas chromatography. J. Chromatogr., v.607, p.150-153, 1992.
BANKOVA, V.; POPOV, S. MAREKOV, N.L. A study on flavonoids of propolis. J. Nat. Prod., v.46, p.471-474, 1983.
BANKOVA, V.; POPOV, S. MAREKOV, N.L. Isopentenyl cinnamates from poplar buds and propolis. Phytochemistry, v.28, p.871-873, 1989.
BLAIR, J.E.; BORMAN, E.K.; BYNOE, E.T.; UPDYKE, E.L.; WILLIAMS, R.E.O. Hospital acquired staphylococcal disease, recommended procedures for laboratory investigation, Atlanta, Ga., United States, Departament of Health, Education and Welfare, Public Health Service.
GHISALBERTI, E.L. Propolis; A review. Bee World, v.60, p.59-84, 1979.
GREENWAY, W.; SCAYSBROOK, T.; WHATLEY, F.R. The composition and plant origins of propolis: a report of work at Oxford. Bee World, v.71, p.107-118, 1990.
HAMMERSCHMIDT, P.A.; PRATT, D.E. Phenolic antioxidants of dried soybeans. J. Food Sci., v.43, p.556-559, 1978.
KOO, H.; GOMES, B.P.F.A.; ROSALEN, P.L.; AMBROSANO, G.M.B.; PARK, Y.K.; CURY, J.A. In vitro antimicrobial activity of propolis and Arnica montana against oral pathogens. Arch. Oral Biol., v.45, p.141-148, 2000a.
KOO, H; VACCA SMITH, A.M.; BOWEN, W.H.;CURY, J.A.; ROSALEN, P.L.; PARK, Y.K. Effect of Apis mellifera propolis on the activities of streptococcal glucosyltransferases in solution and adsorbed onto saliva-coated hydroxyapatite. Caries Res., 2000b. (em publicação).
KOO, H.; ROSALEN, P.L.; CURY, J.A.; AMBROSANO, G.M.B.; MURATA, R.M.; YATSUDA, R.; IKEGAKI, M.; ALENCAR, S.M.; PARK, Y.K.. Effect of a new variety of Apis mellifera propolis on mutans streptococci. Cur. Microbiol., 2000c. (em publicação).
KOO, H; PARK, Y.K.; IKEGAKI, M.; CURY, J.A.; ROSALEN, P.L. Effect of Apis mellifera propolis from two Brazilian regions on caries development in desalivated rats. Caries Res., v.33, p.393-400, 1999.
KOO, M.H.; PARK, Y.K. Investigation of flavonoid aglycones in propolis collected by two different varieties of bees in the same region. Biosci. Biotech. Biochem., v.61, p.367-369, 1997.
PARK, Y.K.; IKEGAKI, M.; ALENCAR, S.M.; WANG, SH.K.; BASTOW, K.; COSENTINO, M.; LEE, K.H. Determinação das atividades citotóxica e anti-HIV dos extratos etanólicos de própolis coletados em diferentes regiões do Brasil. Mensagem Doce, v.56, p.2-5, 2000.
PARK, Y.K; KOO, M.H.; IKEGAKI, M.; CURY, J.A; ROSALEN, P.L.; ABREU, J.A.S. Antimicrobial activity of propolis on oral microorganisms. Cur. Microbiol., v.34, p.24-28, 1998a.
PARK, Y.K.; KOO, H; IKEGAKI, M.; CURY, J.A. & ROSALEN, P.L. Effect of propolis on Streptococcus mutans, Actinomyces naeslundii and Staphylococcus aureus. Rev. Microbiol., v.29, p.143-148, 1998b.
PARK, Y.K. & IKEGAKI, M. Preparation of water and ethanolic extracts of propolis and evaluation of the preparation. Biosci. Biotechnol. Biochem., v.62, p.2230-2232, 1998.
PARK, Y.K; KOO, M.H.; IKEGAKI, M.; CONTADO, J.L. Comparison of the flavonoid aglycone contents of Apis mellifera propolis from various regions of Brazil. Arq. Biol. Tecnol., v.40, p.97-106, 1997.
PARK, Y.K.; KOO, M.H., SATO, H.H.; CONTADO, J.L. Estudo de alguns componentes da própolis coletada por Apis mellifera no Brasil. Arq. Biol. Tecnol., v.38, p.1253- 1259, 1995.
PRATT, D.E.; BIRAC, P.M. Source of antioxidant activity of soybeans and soy products. J. Food Sci., v.44, p.1720-1722, 1979.
PRATT, D.E.; WATTS, B.M. The antioxidant activity of vegetable extracts. I: Flavone aglycones. J. Food. Sci., v.29, p.27-31, 1964.
REISSING, J.L.; STROMINGER, J.L; LELOIR, L.F. A modified colorimetric method for the estimation of N-acetylamino sugars. J. Biol. Chem., v.217, p.959-966, 1955.
|
|
|||
|
|
|
|
|
| Grupo 1 (RS5) |
|
63,0 | Região Sul |
| Grupo 2 (RS1) | Castanho claro | 57,5 | " |
| Grupo 3 (PR7) | Castanho escuro | 65,0 | " |
| Grupo 4 (PR8) | Castanho claro | 54,5 | " |
| Grupo 5 (PR9) | Marrom esverdeado | 58,7 | " |
| Grupo 6 (BA11) | Marrom avermelhado | 45,9 | Região Nordeste |
| Grupo 7 (BA51) | Marrom esverdeado | 43,8 | " |
| Grupo 8 (PE5) | Castanho escuro | 41,3 | " |
| Grupo 9 (PE3) | Amarelo | 46,7 | " |
| Grupo 10 (CE3) | Amarelo escuro | 24,1 | " |
| Grupo 11 (PI1) | Amarelo | 23,1 | " |
| Grupo 12 (SP12) | Verde ou Marrom esverdeado | 61,0 | Região Sudeste |
| Amostras | Zona de Inibição (mm)
Staphylococcus aureus |
Zona de Inibição (mm)
Streptococcus mutans |
| Grupo 1 (RS5) | Negativo | Traço |
| Grupo 2 (RS1) |
|
Negativo |
| Grupo 3 (PR7) | 2,0 | 2,8 |
| Grupo 4 (PR8) | 1,0 | Traço |
| Grupo 5 (PR9) | 3,0 | Traço |
| Grupo 6 (BA11) | 6,0 | 9,0 |
| Grupo 7 (BA51) | 6,0 | 0,5 |
| Grupo 8 (PE5) | 2,0 | 1,0 |
| Grupo 9 (PE3) | Traço | Negativo |
| Grupo 10 (CE3) | Traço | Negativo |
| Grupo 11 (PI1) | Traço | Negativo |
| Grupo 12 (SP12) | 3,0 | 1,0 |
| Amostras | % Inibição da Hialuronidase |
| Grupo 1 (RS5) | 16,1 |
| Grupo 2 (RS1) | 11,8 |
| Grupo 3 (PR7) | 37,9 |
| Grupo 4 (PR8) | 17,1 |
| Grupo 5 (PR9) | 36,4 |
| Grupo 6 (BA11) | 40,8 |
| Grupo 7 (BA51) | 48,6 |
| Grupo 8 (PE5) | 40,8 |
| Grupo 9 (PE3) | 10,6 |
| Grupo 10 (CE3) | 20,1 |
| Grupo 11 (PI1) | 2,4 |
| Grupo 12 (SP12) | 38,3 |


Figura 2 - RP-HTPLC dos extratos etanólicos de própolis

Fig.3: Cromatografia líquida de alta eficiência dos extratos etanólicos de própolis


Figura 4: Atividade antioxidante dos extratos etanólicos de própolis.