USO DE CLORETO DE ALUMÍNIO NA QUANTIFICAÇÃO DE
FLAVONÓIDES EM AMOSTRAS DE PRÓPOLIS
I . Introdução
A própolis, uma resina coletada pelas abelhas
em brotos e exsudatos de plantas, tem uma composição química
bastante complexa. Diversas atividades farmacológicas vêm
sendo comprovadas em ensaios laboratoriais e através do uso em diferentes
formulações, além do tradicional e consagrado extrato
etanólico (Marcucci, 1995).
Em termos de ação farmacológica,
a principal classe de constituintes da própolis é a dos compostos
fenólicos. Essas substâncias caracterizam-se pela presença
de pelo menos um grupo hidroxila ligado diretamente a um anel aromático
(Fig. 1)
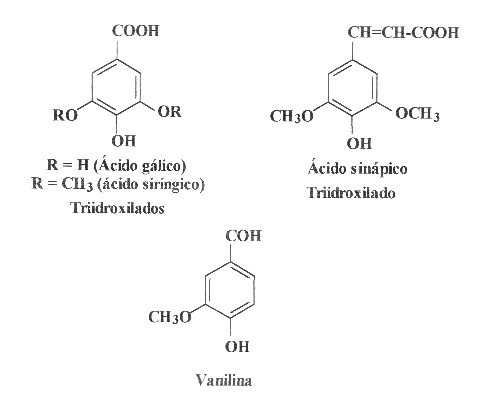
Existem diversas classes de compostos fenólicos que ocorrem de maneira universal nas plantas vasculares e que podem desempenhar importantes papéis na biologia dos animais, principalmente nos fitófagos. Como exemplos, podem-se citar os ácidos fenólicos, como os ácidos benzóico, cafeico, cumárico e ferúlico, e os flavonóides, como a apigenina, o campferol e a quercetina. Alguns compostos fenólicos de origem vegetal são familiares a todos nós, pelo menos em termos organolépticos, como a vanilina (que confere aroma à baunilha), o anetol (responsável pelo aroma do aniz) e o eugenol (muito usado pelos dentistas, presente no óleo de cravo na proporção de 85%, aproximadamente).
Na própolis existem numerosos compostos fenólicos, especialmente flavonóides e ácidos fenólicos. Na própolis Européia, os flavonóides predominam entre as substâncias fenólicas. Por outro lado, as pesquisas recentes sugerem que na própolis brasileira os ácidos fenólicos são bem mais abundantes que os flavonóides. Talvez seja essa particularidade um dos fatores responsáveis pela enorme preferência do mercado internacional em relação a própolis produzida no Brasil. Embora a concentração de flavonóides na própolis brasileira seja relativamente pequena, é possível quantificá-los e utilizar os valores obtidos como parâmetro para o controle de qualidade químico.
Os flavonóides absorvem radiação eletromagnética na faixa do ultravioleta (UV) e do visível e dessa maneira apresentam um papel de defesa das plantas frente à radiação UV da luz solar. Além disso, eles podem representar uma barreira química de defesa contra microrganismos (bactérias, fungos e vírus), insetos e outros animais herbívoros. Mas os flavonóides atuam também em relacionamentos harmônicos entre plantas e insetos, atraindo e orientando esses animais até o néctar, contribuindo enormemente para a polinização (Tomás-Barberán et al., 1994). Esses compostos também desempenham um importante papel na saúde humana. Estando presentes em todas as plantas, eles acabam fazendo parte de nossa dieta. Os flavonóides têm ação antioxidante, minimizando a peroxidação lipídica e o efeito dos radicais livres. Atribui-se às oxidações dos ácidos graxos poliinsaturados (como o ácido linoleico, presente em quantidades relativamente altas no óleo de soja) uma forte influência no estímulo ao desenvolvimento de doenças de grande importância na atualidade, como a arteriosclerose, as enfermidades coronárias e determinados tipos de câncer. Foi demonstrado que indivíduos que ingerem maiores quantidades de flavonóides, os quais são encontrados em alimentos de origem vegetal (verduras, frutas, chá, mel etc.) apresentam uma diminuição considerável do risco de morte por acidentes cardiovasculares (infarto do miocárdio, trombose, derrame etc...) (Kinsella et al., 1993). Residiria nisso uma das virtudes da dieta vegetariana, ou pelo menos, numa dieta com uma marcante proporção de produtos vegetais. Os flavonóides acham-se presentes também em quantidades relativamente altas no vinho tinto. Atribui-se a isso o chamado "paradoxo francês", pelo qual os franceses, apesar de ingerirem uma dieta "menos saudável", pois consomem mais gordura animal, sofrem de uma incidência muito menor daqueles males do que os norteamericanos. Acredita-se que o consumo substancialmente maior de vinho pelos franceses seja a razão por esse resultado paradoxal.
Os flavonóides são quimicamente classificados
de acordo com a presença ou não de um anel central, de uma
dupla ligação no anel e de um grupo hidroxila a ele ligado.
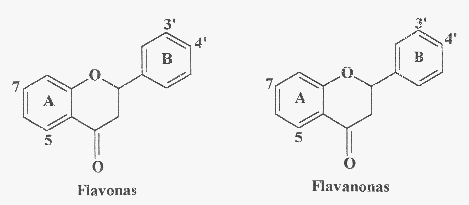
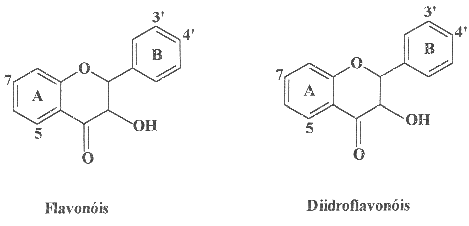
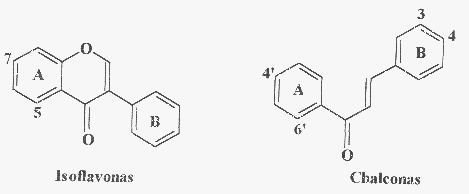
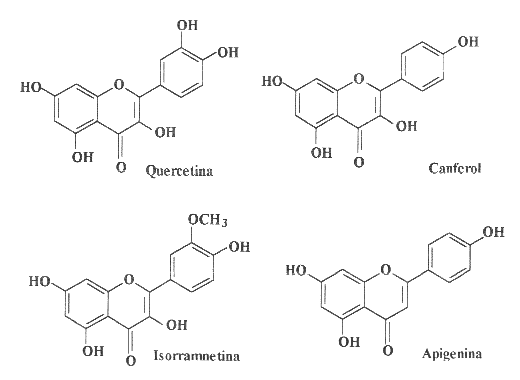
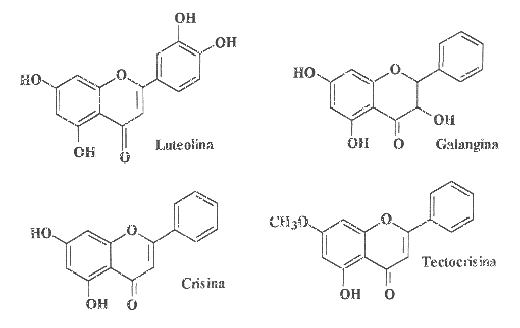
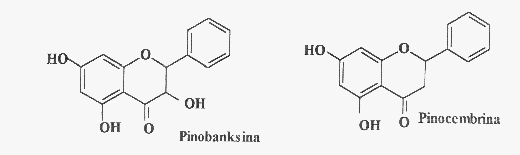
A Fig. 2 apresenta algumas classes de flavonóides que podem estar
presentes em produtos apícolas. A Fig. 3 mostra estruturas de flavonóides
comumente encontrados em própolis: o campferol, a quercetina, a
isorramnetina e a galangina são flavonóis; a apigenina, a
luteolina, a crisina e a tectocrisina são exemplos de flavonas;
a pinocembrina é uma flavanona e a pinobancsina é um diidroflavonol.
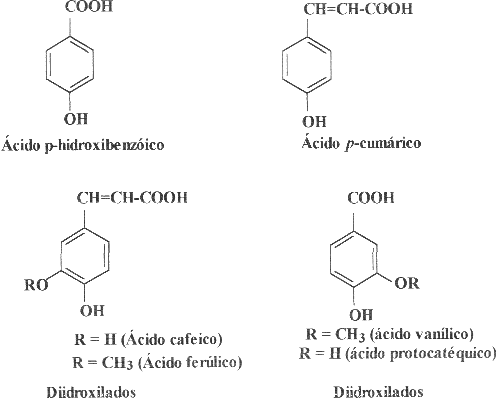
A Fig. 4 mostra exemplos de compostos fenólicos, vários deles
comuns nos produtos apícolas, como os ácido gálico,
p-cumárico, cafeico, ferúlico e siríngico.
II. Utilização do cloreto de alumínio
A maneira mais precisa e exata de se identificar e quantificar flavonóides em produtos naturais é a análise por cromatografia líquida de alta eficiência. No que se refere a análise de própolis, existem numerosos artigos sobre a técnica (Marcucci, 1995). Entretanto, quando se pensa em controle de qualidade, é conveniente a introdução de alternativas mais simples e baratas, pois nesses casos requerem-se procedimentos que permitem a análise rápida de numerosas amostras, em laboratórios geralmente modestos no que se refere ao instrumental instalado e utilizado por analistas na maioria das vezes sem formação superior. Uma das técnicas que se enquadram bem nesse contexto é a determinação de flavonóides totais por espectrometria no UV.
O uso do cloreto de alumínio (AlCl3) no diagnóstico da presença de alguns grupamentos químicos foi pela primeira vez empregado para antocianinas. Trata-se de uma classe de pigmentos do grupo dos flavonóides, encontrados principalmente em flores, mas muitas vezes também em frutos, e que dão ao órgão vegetal colorações que podem variar do vermelho ao azul, passando por todos os matizes intermediários. Em 1954, Harborne sugeriu o uso do cloreto de alumínio para a determinação espectrofotométrica da presença de certos grupamentos químicos em flavonóides (Mabry et al., 1970). Da década de 60 em diante, o composto passou a ser largamente empregado como um reagente de desvios ("shift reagent") em espectrometria no UV-visível para a determinação estrutural de flavonóides (Mabry et al., 1970; Markham, 1982).
Mais recentemente, foi proposta a utilização de métodos espectofotométricos para a determinação de flavonóides totais em plantas, utilizando-se AlCl3 (Schmidt e Ortega, 1993). Vennat et al. (1992) desenvolveram um método para determinar o teor de flavonóides em uma planta, adaptando o método descrito por Dowd (1959) para a quercetina, o qual se baseia no uso de cloreto de alumínio (Woisky, 1996). O cátion alumínio forma complexos estáveis com os flavonóides em metanol, ocorrendo na análise espectrofotométrica um desvio para maiores comprimentos de onda e uma intensificação da absorção (Fig.5). Dessa maneira, é possível determinar a quantidade de flavonóides, evitando-se a interferência de outras substâncias fenólicas, principalmente os ácidos fenólicos (Fig. 4), que invariavelmente acompanham os flavonóides nos tecidos vegetais. A leitura é feita em espectofotômetro a 425 nm, utilizando-se cloreto de alumínio a 2% em metanol (Woisky, 1996; Woisky e Salatino, 1998). Nessas condições, o complexo flavonóide-Al (Fig. 5) absorve em comprimento de onda bem maior do que o flavonóide sem a presença do agente complexante (Tabela I). Os ácidos fenólicos, mesmo os que formam complexos com AlCl3, absorvem em comprimentos de onda muito inferiores (Tabela I), evitando-se dessa maneira interferências nas medidas de absorbância.
O uso do cloreto de alumínio para a determinação da quantidade de flavonóides totais não é, no entanto, um procedimento isento de limitações. O método é preciso, isto é, ele é reproduzível, fornecendo desvios muito pequenos ou nulos entre um ensaio e outro com a mesma amostra. No entanto, ele pode ser pouco exato, ou seja, o valor que ele fornece pode ser diferente (geralmente inferior) em relação à quantidade de flavonóides totais realmente presente na amostra analisada. O valor medido e o valor real são tanto mais próximos entre si quanto maior a proporção de flavonóis na amostra, e tanto mais distantes quanto maior a proporção de flavonas. Isso se deve ao fato de que o comprimento de onda selecionado (425 nm) corresponde à banda de absorção do complexo quercetina-Al. A quercetina é um flavonol, certamente o mais comum dos flavonóides encontrado nas plantas. Os complexos dos outros flavonóis com alumínio absorvem bem próximo de 425 nm, mas os complexos derivados de flavonas absorvem em comprimentos de onda inferiores, o que causa uma subestimativa nas determinações de misturas muito ricas em flavonas.
Tabela I: Bandas de absorção de flavonóides e ácidos
fenólicos em solução metanólica e em presença
de cloreto de alumínio (AlCl3):
| Tipo de flavonóide | Banda I (nm) | Banda II (nm) | Deslocamento provocado por complexação com AlCl3 (nm)** |
| Flavonas | 310-350 | 250-280 | + 35 – 55 * |
| Flavonóis(3-OH substuido) | 330-360 | 250-280 | + 50 - 60 * |
| Flavonóis (sem 3-OH) | 350-385 | 250-280 | + 35 - 55 * |
| Isoflavonas | 310-330 ombro | 245-275 | + 10 - 14 |
| Isoflavonas (5-desoxi-6,7-dioxigenadas) | 320 pico | 275-295 | + 11 - 30 |
| Flavanonas e diidroflavonóis | 300-330 ombro | 230-270 | + 20 – 26 * |
| Chalconas | 340-390 | 230-270 | + 48 - 64 * |
| Auronas | 465-560 | 270-280 | + 40 *
+ 60 - 70 * |
* Têm um desvio batocrômico (para comprimentos de onda maiores)
na faixa de ... (mostrada na tabela).
** Em 425 nm, os ácidos fenólicos e outras substâncias
fenólicas não absorvem em presença de AlCl3, por isso
não há interferência destas substâncias no doseamento
de flavonóides.
No entanto, essa limitação não reduz a validade do método para os propósitos do controle de qualidade. Nesse contexto, é mais importante precisão do que exatidão, pois no controle de qualidade o que normalmente se faz é estabelecer limites inferiores e superiores, dentro dos quais os valores encontrados devem se situar nas condições prescritas pelo método. No caso de amostras de própolis, espera-se que o material de uma certa região, produzido por uma certa linhagem de abelhas, apresente boa uniformidade, caracterizada por determinados parâmetros quantitativos que devem variar muito pouco entre uma partida e outra. É a existência dessa uniformidade que o controle de qualidade procura verificar. Desvios muito grandes em relação aos limites estabelecidos podem significar adulterações, manipulações inadequadas, armazenamento por períodos inaceitavelmente longos, esgotamento dos princípios ativos da amostra etc. A determinação do conteúdo real de flavonóides nas amostras analisadas é menos importante, embora a exatidão seja uma característica desejável nos procedimentos para o controle de qualidade.
Woisky (1996) e Woisky e Salatino (1998) verificaram que o uso do cloreto de alumínio para a análise de amostras e extratos de própolis tem ótima precisão e uma boa exatidão, esta última avaliada através da determinação de uma complexa mistura de flavonóides e ácidos fenólicos.
Outras metodologias têm sido empregadas para
a quantificação de flavonóides em própolis,
tais como a utilização de oxicloreto de zircônio por
Tamas et al. (1983), que relataram a formação do complexo
Zr-flavonóide, com uma absorção no UV em 286 nm. Franco
et al. (1986) utilizando essa técnica, empregaram o oxicloreto de
zircônio para análise de flavonóides em própolis,
sem no entanto verificar a validade da metodologia (Woisky, 1996). Por
exemplo, é preciso verificar se os ácidos fenólicos
também se complexam com o zircônio e em que medida eles poderiam
interferir na medida de absorção pelos complexos flavonóides-Zr.
Sabe-se que vários ácidos fenólicos absorvem fortemente
em 286 nm (Harborne, 1984).
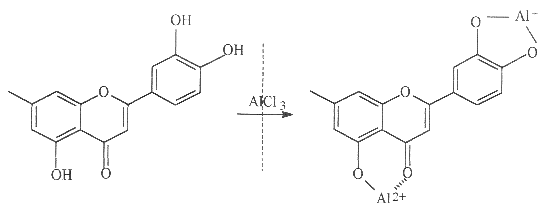
Fig. 5: Formação do complexo Flavonóide-Al, em solução metanólica de cloreto de alumínio (Reproduzido de Markham, 1982).
III. COMENTÁRIOS FINAIS
O cloreto de alumínio tem uma longa tradição como um reagente de desvios em espectrometria UV-visível de flavonóides. Não há a menor dúvida de que o seu emprego na quantificação de flavonóides evita a interferência por parte de ácidos fenólicos presentes em amostras de própolis, freqüentemente em proporções até bem maiores do que a dos próprios flavonóides.
O emprego do cloreto de alumínio em
solução metanólica para fins quantitativos resulta
em uma técnica muito precisa, embora nem sempre exata. Uma técnica
alternativa superior não foi ainda proposta, de modo que recomendamos
o emprego do cloreto de alumínio para o controle de qualidade químico
de amostras e extratos alcoólicos de própolis, mesmo porque
para esses propósitos a precisão dos métodos empregados
é mais importante do que a sua exatidão.
IV. REFERÊNCIAS BIBLIOGRÁFICAS
Dowd LE (1959) Spectrophotometric determination of quercetin, Anal.Chem.
31(7) 1184-1187
Franco TT, Kurebayashi AK (1986) Isolamento de princípios ativos da própolis por cromatografia em papel bidimensional e doseamento espectrofotométrico, Rev. Inst. Adolfo Lutz, 46 (1/2) 81-86
Harborne JB (1984) Phytochemical methods: a guide to modern techniques of plant analysis, Chapman and Hall, London
Kinsella JE, Frankel E, German B, Kanner J (1993) Possible mechanisms for the protective role of antioxidants in wine and plant foods, Food Tecnology, April, 85-89
Mabry, T J, Markham, K R; Thomas, M B (1970) Systematic identification of flavonoids. Springer-Verlag; New York, USA; 354 pp.
Marcucci, M C (1995) Propolis: chemical composition, biological properties and therapeutic activity. Apidologie 26(2): 83-99.
Markham, K R (1982) Techniques of flavonoid identification. Academic Press; London, UK; 113 pp.
Schmidt PC, Ortega GG (1983) Passionsblumenkraut. Bestimmung des Gesamtflavonoidgehaltes von Passiflorae herba, Deutsche Apotheker Zeitung, 133, 17-26.
Tamas M, Marinescu I (1983) Asupra continutului de flavone din mugurii de prop, St.Cerc.Biochim. 26(2) 182-185.
Tomás-Barberán, FA, ferreres, F, Valbuena, AO, Maeso, MCF (1994) Estudio sobre el contenido en flavonoides de las mieles de La Alcarria: su aplicación a la caracterización geográfico-botánica, CSIC, Consejería de Agricultura y Medio Ambiente de La Junta de Comunidades de Castilla-La Mancha, 9-12.
Vennat B, Gross D, Pourrat A, Pourrat H (1992) Hamamelis virginiana: Identification and assay of proanthocyanidins, phenolic acids and flavonoids in leaf extracts, Pharm.Acta Helv., 67(1), 11-14.
Woisky RG (1996) Métodos de controle químico de amostras de própolis, tese de Mestrado apresentada à Faculdade de Ciências Farmacêuticas da USP, para a obtenção do grau de Mestre em Fármacos de Medicamentos, 74 pp.
Woisky RG, Salatino A (1998) Analysis of propolis: parameters and procedures
for chemical quality control, J.Apic.Res., no prelo.