Artigo
A INSEMINAÇÃO INSTRUMENTAL EM ABELHAS Apis mellifera COMO FERRAMENTA NO MELHORAMENTO GENÉTICO
MARTINEZ, Omar Arvey*; De SOUZA, Jairo; BEZERRA-LAURE, Marcela A. F. e SOARES, Ademilson Espencer Egea - Universidade de São Paulo; Faculdade de Medicina de Ribeirão Preto; Departamento de Genética, Ribeirão Preto, São Paulo, Brasil* E-mail para correspondência: omarapis@yahoo.com.br
Introdução
A inseminação instrumental é uma técnica na qual se transfere por meio de equipamentos adequados, o esperma coletado do macho, para o sistema reprodutivo da fêmea e é praticada em vertebrados para criação de animais com fins econômicos ou para conservação biológica. Porém, em invertebrados só alguns poucos casos foram bem sucedidos . Diferentes métodos de controle reprodutivo podem aumentar a taxa de melhoramento genético, associado a uma maior endogamia, o que não acontece com a inseminação instrumental de uma maneira geral, que pode manter a taxa de endogamia a níveis aceitáveis .
No programa de melhoramento genético de abelhas Apis mellifera é necessário o uso de ferramentas como a inseminação instrumental, que permite aumentar os níveis produtivos sem usar os métodos quantitativos tradicionais. Esta técnica é adequada para o pesquisador que precisa de cruzamentos específicos e imprescindível para atender o apicultor envolvido em um programa de melhoramento genético. As diferentes contribuições geradas nos últimos 60 anos possibilitaram o seu desenvolvimento . Surgiu em 1920 e foi gradativamente aperfeiçoada nas décadas de 1940 e 1950, oferecendo ao setor apícola o total controle dos cruzamentos nas abelhas Apis mellifera , facilitando a formação de matrizes de boa qualidade.
Assim, a inseminação permite a seleção, o desenvolvimento e a manutenção de características, sejam elas produtivas, comportamentais, de tolerância e/ou de resistência a enfermidades, justificando o seu emprego em programas comerciais de criação e melhoramento de abelhas Apis mellifera .
A inseminação é uma ferramenta valiosa que quando utilizada no melhoramento facilita a seleção de características desejáveis. Permite tipos de acasalamentos que não são possíveis naturalmente, como a fecundação por poucos ou com um só macho e mesmo o cruzamento controlado com indivíduos mutantes . Em casos excepcionais pode-se até fecundar uma rainha virgem com os seus próprios filhos.
Naturalmente as rainhas podem se acasalar com machos de origens desconhecidas e produzirem operárias com características indesejáveis. A inseminação assegura que o apicultor se beneficie de programas de melhoramento nos quais se pode manter um isolamento genético total, permitindo a produção de rainhas consistentes e de alta qualidade, selecionadas para uma característica específica e com uma alta variabilidade genética .
A técnica tem a flexibilidade necessária para realizar muitos tipos de acasalamentos controlados. Porém, uns dos mais utilizados é a inseminação de rainhas com uma mistura uniforme de espermatozoides. Entre outras possibilidades, ela pode ser usada para manter a heterogeneidade genética no programa de melhoramento ou para produzir inseminações uniformes, mais heterogêneas geneticamente, em um grupo determinado de rainhas .
Nas abelhas um zangão produz entre seis e dez milhões de espermatozoides o que corresponde a 1,5 microlitros de sêmen aproximadamente. As rainhas se acasalam naturalmente com mais de 10 machos, os quais transferem mais de 100 milhões de espermatozoides no voo de acasalamento. Porém, só de três a cinco milhões destes migram por meios passivos e ativos para a espermateca. Durante a inseminação são depositados oito microlitros de sêmen nos ovidutos médios de rainhas virgens com aproximadamente 5 a 7 dias de idade. A técnica tenta simular a quantidade depositada no acasalamento natural, e que tem se mostrado suficiente para encher completamente a espermateca das rainhas inseminadas .
A inseminação de rainhas não é difícil para aqueles que estão familiarizados com o uso de estereomicroscópios. Vale ressaltar, entretanto, que o equipamento seja o adequado, estéril, preciso e que o técnico tenha uma boa habilidade e delicadeza durante a execução dos procedimentos .
Alguns complementos importantes a esta técnica na apicultura especializada e que geralmente são ignorados por iniciantes são: criação e maturação dos machos e das rainhas; cuidados na pré e pós-inseminação; e a introdução adequada das rainhas inseminadas. O êxito depende de um cuidadoso planejamento de todos estes processos . A produção de zangões é de caráter fundamental, oferecendo uma grande quantidade de zangões de colônias previamente selecionadas . A seleção dos machos deve ser feita a partir do desempenho de suas irmãs, já que a maioria das avaliações é realizada nas operarias da colmeia .
Atualmente o procedimento se tornou simples e seguro com as melhorias da técnica e no design dos equipamentos. Assim, é possível se conseguir altas taxas de sucesso e níveis de desempenho das rainhas inseminadas similares aos das rainhas fecundadas naturalmente. As diferenças entre rainhas acasaladas naturalmente e rainhas inseminadas devem-se principalmente a quantidade de sêmen utilizado, idade das rainhas, métodos de introdução, e os cuidados pré e pós-inseminação . Em países industrializados esta técnica está muito bem desenvolvida a ponto de praticamente não existirem diferenças entre as rainhas acasaladas naturalmente e as rainhas inseminadas, resultando em colônias altamente produtivas, facilmente evidenciadas .
Em estudos realizados com abelhas africanizadas foi possível constatar que rainhas inseminadas formam colônias fortes e que podem ser testadas em campo quanto a sua produtividade . Recentemente , se conseguiu colônias que cresceram rapidamente passando de um núcleo de cinco favos para colônias com uma ou duas câmaras e mais de dez favos com crias (aberta e fechada) e com rainhas que realizaram postura por mais de um ano. Desta forma, podemos afirmar com total convicção, que hoje é possível se ter na apicultura comercial rainhas inseminadas instrumentalmente e que apresentem o mesmo desempenho de rainhas acasaladas naturalmente.
A inseminação permite que todo o genótipo materno e paterno seja selecionado e que as colônias com rainhas inseminadas sejam avaliadas diretamente sem a interferência da alta variabilidade da sua progênie. Colônias produtivas com rainhas inseminadas são importantes para o estudo da herança dos caracteres como, por exemplo, a produção de mel, própolis e outros produtos das abelhas .
De forma controlada, o apicultor desenvolveu o conhecimento básico e prático para a produção de rainhas. As novas rainhas são produzidas a partir de larvas de operárias entre 12 e 24 horas de idade, que são transferidas para cúpulas que podem ser de cera, plástico, porcelana, destinadas a esta finalidade .
O desenvolvimento das novas rainhas é realizado ao interior de colmeias preparadas previamente. As rainhas recém-emergidas são introduzidas individualmente nas colmeias órfãs e após cerca de duas semanas elas já terão se acasalado e iniciado a postura.
As rainhas virgens ou fecundadas naturalmente podem ser comercializadas e vendidas em gaiolas individuais juntamente com operárias jovens . As rainhas virgens podem ser inseminadas instrumentalmente a partir do quinto dia de idade e preferencialmente não deve ultrapassar do sétimo dia .
Desenvolver o hábito de trocar as rainhas anualmente é um passo essencial a ser tomado na implantação de um programa de melhoramento genético produtivo. Desta forma podemos trocar em um pequeno intervalo de tempo toda a genética de cada colmeia. Aprender e aperfeiçoar as técnicas da criação de rainhas é tarefa de alguns apicultores os quais devem se especializar em fornecer rainhas a outros apicultores. A troca de rainhas traz muitas vantagens para os produtores, permitindo um monitoramento mais preciso das colmeias e respostas mais rápidas à seleção.
As características da rainha, tais como: longevidade, capacidade de postura, cria homogênea, resistência a doenças, entre outras, são de fundamental importância para manter o potencial de produção da colônia. Estas características podem ser usadas na seleção de futuras linhagens na produção comercial de mel, pólen, própolis, cera e geleia real .
Em climas tropicais a rainha pode realizar postura o ano inteiro, mas seu desgaste é alto e por isso precisa ser trocada por uma nova ao final do período produtivo. Rainhas velhas e de baixa qualidade genética refletem na baixa produtividade do apiário com colônias improdutivas, as quais aumentam o tempo de trabalho do apicultor e consequentemente oneram os custos de produção alterando os preços do produto final .
Por esse motivo é muito interessante que o apicultor mantenha em suas colônias rainhas jovens e com características desejadas, para que assim possam transmiti-las para sua prole e futuras rainhas . Porém, a troca anual de rainhas ainda é uma prática pouco estabelecida pelo apicultor e no Brasil podemos considerar que a maioria dos apicultores não substituem suas rainhas. Isso se deve em parte ao tipo de manejo que é realizado nos apiários de produção e em parte ao desconhecimento das vantagens que existem na troca contínua das rainhas . Quando esta prática começa a ser desenvolvida é comum observar um aumento na produção dos apiários além da possibilidade de manter colônias fortes e homogêneas durante a maior parte do ano .
Existe uma grande variedade de aparelhos disponíveis, que variam em custo, qualidade e facilidade de uso. A escolha pode fazer a diferença no sucesso ou frustração do uso desta técnica. O procedimento é delicado e requer precisão e exatidão nos movimentos, além de uma alta repetibilidade .
Procedimento da Inseminação Instrumental
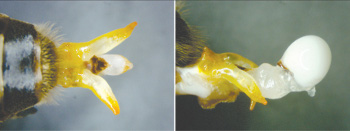
Figura 1. (A) Eversão parcial do órgão reprodutor do zangão.
(B) Eversão total, mostrando na extremidade o muco e o sêmen
respectivamente
Coleta de sêmen
A coleta de sêmen é possivelmente o ponto chave durante a inseminação instrumental de abelhas Apis mellifera. Este procedimento exige especial cuidado, pois tem que ser evitado a coleta de muco e bolhas de ar, as quais alteram o perfeito funcionamento durante a introdução do sêmen e acarretam perda de tempo durante a inseminação.
Previamente os zangões são coletados nas colônias selecionadas e mantidos presos em uma gaiola e devem ser transportados rapidamente à sala onde será realizada a inseminação, que deverá estar com temperatura adequada para a sobrevivência dos zangões.
Manualmente, um a um os zangões são retirados da gaiola para a coleta do sêmen. São presos entre o dedo indicador e polegar, exercendo-se uma leve pressão sob a cabeça e tórax. Dependendo da maturidade do zangão ele pode fazer uma eversão parcial do aparato reprodutivo e as vezes até total eversão do endofalo. Se a eversão não é completa, o abdômen é pressionado progressivamente com um movimento antero posterior até conseguir a sua eversão total, como pode ser visto na figura 1. .
De forma geral o sêmen de cor marrom claro fica aglomerado na parte superior do muco que tem uma cor branca. Em algumas ocasiões ele pode ficar espalhado no muco ou em parte do endofalo. Para fazer a coleta o zangão deve ser levado próximo do capilar e com muita firmeza, mas de forma suave o sêmen deve ser encostado na ponta do capilar e levemente puxado com a ajuda do micrômetro de forma progressiva até retirá-lo totalmente. Bolhas de ar e muco não devem ser puxadas para dentro do capilar, pois eles poderão entupi-lo. Entre cada coleta a ponta do capilar deve ser umedecida com solução salina para prevenir o ressecamento e manter a mobilidade do sistema. Este processo é repetido até se coletar a quantidade necessária de sêmen. Após terminar a coleta de sêmen uma pequena bolha de ar é deixada e é coletado aproximadamente 1 µl de solução para evitar o ressecamento do sêmen.
Procedimento de inseminação

Figura 2. (A) Estereoscópico e equipamento
de inseminação. (B) Equipamento de inseminação
e (C) Suporte para fixação da rainha.
A inseminação é iniciada regulando o fluxo de gás carbônico conectado através de um tubo diretamente ao suporte que segura a rainha, e é responsável pelo adormecimento dela durante todo o procedimento. Regulado o fluxo de gás a rainha é inserida no suporte, onde fica posicionada e presa firmemente (Figura 2).
Em seguida de forma suave e precisa o gancho ventral é inserido na abertura vaginal. No momento da rainha adormecer, ela pode expor o ferrão, facilitando o trabalho de prendê-lo com o fórceps. Se isso não ocorrer, o fórceps é primeiramente usado como um gancho dorsal puxando suavemente pela parte interna do dorso da rainha e com um gancho adicional o ferrão é levantado para prendê-lo com o fórceps. O ferrão deve se prender em uma altura media adequada, pois, muito alto poderá escapar e muito baixo poderá atrapalhar a inserção do capilar. O gancho ventral e o fórceps são manobrados para deixar a rainha na posição final, a rainha fica levemente esticada e com uma abertura media para a inserção da ponta do capilar (Figura 3).
Uma vez que a rainha esta na posição certa, a ponta do capilar é cuidadosamente inserida, mais dorsalmente possível permitindo a passagem da válvula na entrada do conduto vaginal. Posteriormente, um movimento dorso ventral é realizado para permitir que o capilar seja novamente introduzido (1 mm aproximadamente). Em seguida giramos suavemente o êmbolo da seringa que controla a introdução do sêmen. Se a solução salina na ponta do capilar descer sem nenhuma obstrução ou refluxo, são introduzidos 8 µl de sêmen em cada uma das rainhas inseminadas.
Finalmente o capilar é retirado da rainha. Em seguida, o sêmen é puxado com a ajuda do êmbolo da seringa e novamente é coletada solução salina que evitará o seu ressecamento. A rainha é liberada do fórceps e do gancho ventral. A seguir a rainha é retirada do suporte, marcada e uma asa é cuidadosamente cortada. Após a inseminação a rainha é introduzida na respectiva colônia e 24 horas após a inseminação, é levada novamente para o laboratório com o objetivo de dar um choque de gás carbônico por aproximadamente 5 minutos. Isto estimulará a migração espermática e o início da postura.
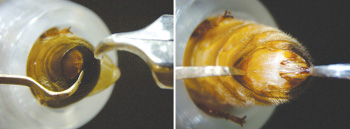
Figura 3. Procedimento para a inseminação. (A) Posicionamento
da rainha. (B) Abertura da rainha com o auxilio do gancho ventral
e fórceps dorsal para facilitar a entrada da ponta do capilar
no canal vaginal.
Atualmente a inseminação instrumental é considerada uma técnica rotineira e muito bem desenvolvida no Departamento de Genética da Faculdade de Medicina de Ribeirão Preto - USP e não apresenta nenhuma barreira ou dificuldade nos períodos pré e pós inseminação. Isso se deve às diversas inseminações realizadas durante os últimos anos, que possibilitaram aperfeiçoar e desenvolver habilidades suficientes para realização da técnica de inseminação instrumental e comprovar a postura das rainhas.
Na Figura 4 observamos o padrão de postura de uma rainha cuja inseminação foi realizada há mais de cinco meses, apresentando um excelente padrão de cria, o que nos permite garantir que a utilização da técnica pode e deve ser utilizada em colmeias produtivas.
O melhoramento genético de abelhas apresenta algumas diferenças em relação a outras espécies animais, estimativas como herdabilidade, semelhança entre parentes e outras são difíceis de serem obtidas pelo fato das colônias apresentarem uma estrutura genética interna que dificulta tal procedimento. Nos acasalamentos que ocorrem de forma natural desconhecemos a origem dos zangões que se acasalaram com as rainhas nos voos de fecundação, além disto, os acasalamentos múltiplos também afetam a predição destas estimativas.

Figura 4. Padrão de postura de uma rainha inseminada após
aproximadamente cinco meses da inseminação.
Soma-se ainda a condição haplo-diploide das abelhas e dessa forma, pedigrees de abelhas podem se tornar complicados, e as estimativas de endogamia deveriam ser calculadas individualmente. Em alguns programas de melhoramento, especialmente aqueles que envolvem endocruzamento intensivo, só um ou uns poucos tipos de acasalamento são usados . Estas peculiaridades tornam a inseminação ferramenta de caráter obrigatório na avaliação de algumas destas características assim como também no melhoramento genético de abelhas africanizadas.
Atualmente estamos trabalhando em parceria com a Natucentro Ind. e Apiários C.O. Ltda. (Bambuí - MG), com o objetivo de testar rainhas inseminadas diretamente nas colônias utilizadas na produção de própolis verde e assim poder estimar valores genéticos com este tipo de material.
Referencias Bibliográficas
1. Laidlaw, H.H., Production of queens and package bees, in The hive and the honey bee, J.M. Graham, Editor. 2000, Dadant & Sons. Ed. Bookcrafters. p. 989-1042.
2. Nicholas, F.W., Genetic improvement through reproductive technology. Animal Reproduction Science, 1996. 42(1-4): p. 205-214.
3. Cobey, S.W., Comparison studies of instrumentally inseminated and naturally mated honey bee queens and factors affecting their performance. Apidologie, 2007. 38(4): p. 390-410.
4. Schley, P. Instrumental bee Insemination : process. Short Instructions to instrumental bee insemination Drones and Queens. [cited 2008; Available from: http:// www.besamungsgeraet.de/__en/ the-insemination-process/.
5. Cobey, S., The Development of Instrumental Insemination .1. American Bee Journal, 1983. 123(2): p. 108-111.
6. Laidlaw, H.H.J., Instrumental Insemination of honey bee queens: Its origin and development. Bee World, 1987. 68(1): p. 17-36.
7. Flores, J.M., et al., Inseminación Artificial de Abejas Reinas. Archivos de zootecnia, 1998. 47(178): p. 343-345.
8. Cobey, S. and P. Schley, Innovations in instrumental insemination - The compact, versatile right & left handed Schley Model II instrument. American Bee Journal, 2002. 142(6): p. 433-435.
9. Soares, A.E.E. and J.C. Netto, Laranja - an Additional Eye Color Gene in the Snow Series of Apis- -Mellifera L. Journal of Heredity, 1982. 73(1): p. 80-80.
10. Soares, A.E.E., Split-Sting - a New Honeybee Character. Journal of Apicultural Research, 1981. 20(3): p. 140-142.
11. Soares, A.E.E., Chartreuse- -Limao - 1st Eye Mutation Induced by Gamma-Radiation with Co-60 in the Honeybee. Journal of Apicultural Research, 1981. 20(3): p. 137-139.
12. Harbo, J.R., Propagation and instrumental insemination, in Bee genetics and breeding, T.E. Rinderer, Editor. 1986, Academic Press. p. 361-389.
13. Page, R.E. and H.H. Laidlaw, Honey bee genetics and breeding, in The hive and the honey bee, J.M. Graham, Editor. 2000, Dadant & Sons. Ed. Bookcrafters. p. 235-267.
14. Fert, G., Cría de reinas: Selección de la raza, Métodos de cría, La producción de jalea real. 2010.
15. Büchler, R., et al., Standard methods for rearing and selection of Apis mellifera queens. Journal of Apicultural Research, 2013. 52(1).
16. Vencovsky, R. and W. Kerr, Melhoramento Genético em Abelhas. II. Teoria e avaliação de alguns métodos de seleção. Revista Brasileira de Genética, 1982. 3: p. 493-502.
17. Al-Qarni, A.S., B.H. Smith, and S.W. Cobey, Performance evaluation of naturally mated and instrumentally inseminated honeybee (Apis mellifera L.) queens in field colonies. Pakistan Journal of Biological Sciences, 2003. 6: p. 1476-1481.
18. Moreno, U.V., Implementação da inseminação instrumental de abelhas rainhas africanizadas (Apis mellifera) como ferramenta importante no melhoramento genético de características produtivas, in Faculdade de Medicina de Ribeirão Preto, Departamento de Genética.2006, Universidade de São Paulo.: Ribeirão Preto, São Paulo.
19. Martínez, O.A., Melhoramento genético e seleção de colmeias para aumento da produção de própolis verde na apicultura comercial, in Faculdade de Medicina de Ribeirão Preto, Departamento de Genética. 2012, Universidade de São Paulo.: Ribierão Preto, São Paulo. p. 138.
20. Page, R.E. and H.H. Laidlaw, Mating designs, in Bee genetics and breeding, T.E. Rinderer, Editor. 1986, Academic Press. p. 305-321.
21. Lawrence, J.C., Queen Reading Essentials. 2009, Kalamazoo, Michigan: Wicwas Press.
22. Tucker, K.W., Queens, Package Bees, and Nuclei: Production and Demand. , in Beekeeping in the United States. 1980, US Dept. Of Agriculture: Washington. DC. p. 58-63.
23. Seabra-Filho, J.R. Geléia real. in XI CONGRESSO BRASILEIRO DE APICULTURA. 1996. Teresina, Piauí.
24. Soares, A.E.E., R. Almeida, and M.A. Bezerra-Laure. Avanços no melhoramento genético e na inseminação instrumental em Apis mellifera. in 11 CONGRESSO BRASILEIRO DE APICULTURA. 1996. Teresina, Piauí: Confederação Brasileira de Apicultura.
25. Cunha, J.G.C. Melhoramento de abelhas e produção de rainhas. in XIV CONGRESSO NACIONAL DE APICULTURA. 2002. Campo Grande, Mato Grosso do Sul: Confederação Brasileira de Apicultura.
26. DeJong, D., Africanized honey bees in Brazil, forty years of adaptation and success. Bee World, 1996. 77(2): p. 67-70.
27. Alber, M.A. and S. Messina, A study of queen-rearing methods. Bee World, 1965. 46(1): p. 25-31.
28. Cobey, S., The extraordinary honey bee mating strategy and a simple field dissection of the Spermatheca - A three-part series - Part 1 - Mating behavior. American Bee Journal, 2003. 143(1): p. 67-69.
29. Li, J.K., et al., How royal jelly maintains its quality within the colony. American Bee Journal, 2005. 145(9): p. 736-738.
30. Kostarelou-Damianidou, M., et al., Brood and honey production of honey bee colonies requeened at various frequencies. Journal of Apicultural Research, 1995. 34(1): p. 9-14.
31. Kemp, J. Simplificación de los aparatos para inseminación de las abejas reinas. in Apimondia - 2nd World Symposium of Queen Bees and Artificial Insemination. 2008. Nuevo Vallarta, Nayarit. Mexico.