Artigo
Estratégias reprodutivas dos machos de abelhas melíferas e sem ferrão
Charles Fernando dos Santos1 & Vera Lucia Imperatriz-Fonseca21. Programa de pós-graduação em Zoologia, Laboratório de Abelhas, Universidade de São Paulo.
2. Laboratório de Abelhas, Instituto de Biociências, Universidade de São Paulo.
As fêmeas das abelhas (Hymenoptera: Apoidea), sejam elas solitárias ou sociais, devotam considerável atenção no cuidado e amparo de suas crias desde preparar um abrigo (ninho) e defendê-lo de intrusos até oferecer à prole uma quantidade de alimento suficiente para seu desenvolvimento até a fase adulta (Michener 1974). Em espécies eusociais, como as que serão tratadas aqui (Apis mellifera, Apini; Melipona spp., Trigona spp. e afins, Meliponini), a complexidade é tanta que se pode observar não apenas a divisão de trabalho entre as castas de rainhas e operárias, mas também uma especialização de tarefas entre as operárias de diferentes idades e funções na construção de favos, cuidado com a cria, limpeza do ninho, defesa do mesmo, forrageamento dentre muitas outras atividades (Michener 1974). As rainhas desempenham o papel reprodutivo, porém, não exclusivo, porque eventualmente operárias de algumas espécies podem colocar ovos reprodutivos, principalmente em colônias órfãs, por um processo denominado partenogênese.
Nesse reinado feminino, os machos praticamente não executam tarefas específicas dentro do ninho e quando fazem são tarefas pontuais (Nogueira-Neto 1997; Velthuis et al. 2005), passageiras ou de interesse próprio como auto-limpeza, imobilidade em favos de cria, trofaláxis com companheiros e desidratação de néctar (Cortopassi-Laurino 2007). A única função desses indivíduos é fecundar uma rainha virgem durante o voo nupcial delas. O ciclo de vida dos machos nem por isso chega a ser pura boemia. Eles também estão sujeitos a pressões seletivas como competição, predação, parasitismo e escolha feminina, fatores que têm moldado não apenas seus comportamentos, mas também a morfologia como olhos e antenas maiores que as fêmeas (Snodgrass 1910; Ribi et al. 1989) e a fisiologia, como a quantidade prefixada de espermatozóides quando emergem (Kerr & Krause 1950; Mazeed & Mohanny 2010). Há ainda uma carga genética sobre eles porque se nascerem diplóides todo o esforço para se acasalarem será em vão. Isso porque os machos sexualmente férteis das abelhas possuem apenas um jogo de cromossomos nos núcleos das células e não dois jogos como as fêmeas (Cook & Crozier 1995). Caso nasçam com dois lotes e tiverem no locus que determina o sexo uma combinação igual ao da rainha virgem, sua parceira sexual, (e.g. A x A) serão machos diplóides e inférteis.
A fase da vida mais excitante e ativa para os machos de Apini e Meliponini é quando eles iniciam sua fase reprodutiva. Os machos sexualmente maduros de Apis mellifera iniciam pequenos vôos de orientação, abandonando temporariamente seus ninhos e se dirigindo para as áreas de congregação de machos (descrita abaixo), mas retornado aos ninhos de origem para se alimentarem e dormirem (Ruttner 1956; Koninger et al. 2005a). Por outro lado, os machos sexualmente maduros de Meliponini abandonam permanentemente suas colônias, se alimentam em flores (Kerr et al. 1962; Nogueira-Neto 1997; Velthuis et al. 2005) e são vistos novamente apenas em enxames reprodutivos.
Diferentemente das abelhas solitárias, onde as fêmeas reprodutivas emergentes procuram prontamente porções na vegetação ou nas flores onde possam se limpar ou buscar alimento para elas ou sua cria (Alcock et al. 1978; Eickwort & Ginsberg 1980; Paxton 2005), as fêmeas reprodutivas (rainhas virgens) de Apini e Meliponini não coletam alimento nas flores tampouco constroem ninhos. Tudo isso já está ou será provido por suas operárias. Os machos dessas abelhas sociais, portanto, adaptaram suas estratégias reprodutivas de acordo com os hábitos de suas parceiras sexuais. Assim, em vez de patrulharem flores ou ninhos, demarcarem territórios na vegetação ou empoleirarem solitariamente em substratos como ponto de observação (Alcock et al. 1978; Eickwort & Ginsberg 1980; Paxton 2005), os machos de Apini e Meliponini se aglomeram! (Nogueira-Neto 1954; Ruttner 1956; Butler 1971; Roubik1990; Imperatriz-Fonseca et al. 1998; Koniger et al. 2005a; Paxton 2005; Cortopassi-Laurino 2007; López & Kraus 2009) - Figura 1.
 Figura 1. Machos de Trigona spinipes (irapuá) pousados sobre o ninho à espera do voo nupcial da rainha virgem (Charles Santos). |
 Figura 2. Machos de Nannotrigona testaceicornis (iraí) sobrevoando entrada de ninho à espera do voo nupcial da rainha virgem (Charles Santos). |
 Figura 3. Machos de Melipona subnitida (jandaíra) aglomerados sobre o tronco de uma árvore (cortesia de Dr. Cristiano Menezes). |
 Figura 4. Machos de Tetragonisca angustula (jataí) pousados próximos à entrada da colônia (não mostrada) espera do voo nupcial da rainha virgem e um macho de Scaptotrigona depilis (canudo). |
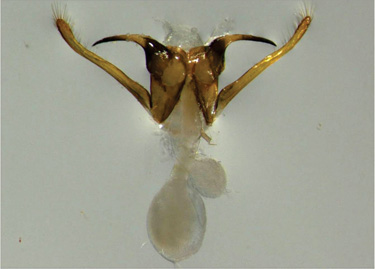 Figura 5. Genitália masculina de Scaptotrigona aff. depilis (canudo). Porções quitinizadas em marrom claro: endóstilos (com cerdas) e ganchos (pontiagudos). Porções arredondadas e esbranquiçadas: testículos com espermatozóides (cortesia de Dr. Cristiano Menezes). |
 Figura 6. Rainha de Scaptotrigona aff. depilis recém acasalada com sinal de acasalamento visível no final do abdome (cortesia de Dr. Cristiano Menezes). |
Aglomerar-se pode ser uma estratégia melhor do que aguardar a fêmea isoladamente à espera de um encontro romântico (rendez-vous) porque se as rainhas virgens não buscam flores nem constroem ninhos, o aglomerado de machos chama a atenção e pode ser a única alternativa para elas encontrarem seus parceiros. Como tais aglomerados se formam ainda é uma questão aberta: (1) os machos poderiam atrair novos companheiros a fim de aumentar o aglomerado e, consequentemente, a atenção das fêmeas; (2) dirigir-se-iam para aglomerados já formados, independentes de terem sido atraídos (convidados); (3) patrulhariam ninhos onde há a presença de rainhas virgens e esse comportamento poderia progressivamente ir estruturando o aglomerado. O fato é que o aglomerado é uma estratégia rígida, fixa, sem segunda opção ou plano B, como pode ocorrer nos machos de abelhas solitárias (Alcock et al. 1978; Eickwort & Ginsberg 1980; Paxton 2005).
Os aglomerados formados por machos de abelhas melíferas ocorrem preferencialmente no período da tarde em dias quentes e ensolarados e são denominados áreas de congregação de machos (Ruttner 1966). Essas áreas possuem indivíduos de colônias, por vezes, localizadas a quilômetros de distância e se estabelecem a vários metros acima do solo, sem qualquer substrato aparente, geralmente em lugares abertos podendo ter de 50 a 200 metros de diâmetro (Butler 1971; Baudry et al. 1998; Koeniger et al. 2005a, b; Galindo-Cardona 2010). As áreas de congregação se formam ano após anos nos mesmos locais e podem ocorrer várias em uma mesma região com os machos se distribuindo entre elas (Koeniger & Koeniger 1991), mas geralmente nas mais próximas de suas colônias de origem (Koeniger et al. 2005a). As rainhas virgens de Apis mellifera se deslocam até essas congregações e atraem os machos com um feromônio sexual de suas glândulas mandibulares e, potencialmente, incrementando-o com substâncias odoríferas do abdome (Butler 1971).
O aglomerado formado por machos de abelhas sem ferrão é completamente diferente daquele dos machos de abelhas melíferas. Em Meliponini há basicamente dois tipos de aglomerados, (a) aqueles que se estabelecem sobre um substrato distantes das colônias com rainhas virgens presentes, como Melipona sp. (Sommeijer & Bruijn 1995) - Figura 2 e (b) aqueles que se formam nas proximidades da entrada da colônia, como Nannotrigona spp., Scaptotrigona spp., Tetragonisca spp., e Trigona spp. e outros, atraídos possivelmente por odores atrativos das rainhas virgens (Nogueira-Neto 1954; Engels & Engels 1984; van Veen & Sommeijer 2000; Velthuis et al. 2005) - Figura 3. No primeiro caso, as rainhas virgens podem estar sendo atraídas pelos machos por meio de odores liberados pelos mesmos, os quais também recebem visitas de operárias, embora não se saiba a função delas nesses eventos (Sommeijer et al. 2003). No segundo caso, os machos se dirigem até as colônias e ali, pousados ou sobrevoando, aguardam por dias ou semanas o voo nupcial da rainha virgem. Poucos dias após a rainha se acasalar o aglomerado já não se forma mais. Em dias frios, chuvosos e com muito vento, mesmo havendo rainha virgem, raramente aparece algum macho para tentar se acasalar (Cortopassi-Laurino 2007).
Os aglomerados formados por machos de abelhas melíferas e abelhas sem ferrão provê à suas rainhas virgens uma ampla diversidade de indivíduos residentes em uma determinada região com histórias evolutivas diferentes. Desse modo, cada macho presente no aglomerado traz uma herança genética gravada no DNA de seus espermatozóides com diferentes adaptações regionais que será passada para sua futura prole no que diz respeito a resistência a doenças, parasitismo, condições ambientais adversas, até mesmo adaptações a certas floradas de determinadas regiões. Outra característica importante dos aglomerados é que neles as possibilidades de encontros entre parceiros (rainhas - machos) aparentados ou irmãos são mínimas (Baudry et al. 1998; Collet et al. 2009), pois, cerca de 70% a 90% dos machos presentes em um aglomerado não são aparentados às rainhas virgens (Paxton 2000; Kraus et al. 2008). Esse parentesco mínimo é alcançado porque muitos ninhos naturais ou racionais localizados dentro e próximos dos apiários/ meliponários contribuem com machos, os quais podem vir de mais que 30 ou, surpreendentemente, 130 ninhos diferentes (Paxton et al. 2003; Cameron et al. 2004).
A razão sexual nesses aglomerados é altamente enviesada em machos, ou seja, a quantidade de machos para cada fêmea reprodutiva é extremamente desproporcional. Desse modo, se estar congregado aumenta as chances das rainhas virgens encontrarem os machos, por outro, estar junto de outras centenas de companheiros aumenta grandemente a competição e, assim, as chances de um macho se acasalar diminuem a cada indivíduo que venha a se somar no aglomerado. Portanto, mais do que tentar acasalar muitas vezes, o macho tem que conseguir ao menos copular (Boomsma et al. 2005). Interessante é que eles não utilizam qualquer agressividade aparente sobre seus competidores (Roubik 1990; Koeniger et al. 2005b; López & Kraus 2009), embora um certo alvoroço possa ser observado em alguns casos.
Além da competição, os indivíduos presentes nos aglomerados sofrem chances reais de serem predados por pássaros ou vespas (Karcher et al 2008; Koedam et al. 2009, 2010), serem parasitados por moscas forídeas (Meliponini; Brown 1997) ou já chegarem parasitados por ácaros Varroa no caso de zangões de A. mellifera. Neste último caso, inclusive, os zangões de Apis podem ser o principal meio de propagação desse parasita entre as colônias já que podem ser aceitos em colônias diferentes das suas de origem ou mesmo de outra raça (Koeniger et al. 2005a; Galindo-Cardona 2010). Um fato curioso é que as congregações ou aglomerados podem contar ainda com a presença de machos de outras raças (Apini; Koeniger et al. 2005b; Collet et al. 2009) ou espécies (Meliponini; Nogueira-Neto 1954; Kerr et al. 1962; Cortopassi-Laurino 2009). Por exemplo, em dois aglomerados de jataí (Tetragonisca angustula) recentemente observados foram registrados machos de iraí (Nannotrigona testaceicornis) e canudo (Scaptotrigona depilis) - Figura 4; não se tem uma explicação biológica para essas ocorrências ainda, porém, não se observa qualquer antagonismo entre eles nessas situações. Será engano ou há coisas como odores em comum? Estamos investigando o assunto e o trataremos em um trabalho posterior.
Mesmo sujeitos a competição, parasitismo e predação, um eventual encontro com a rainha virgem será fatal! Aqueles machos que conseguirem se acasalar com ela morrerão quase que instantaneamente porque sua genitália ficará presa no trato reprodutivo feminino formando um plug ou sinal de acasalamento (Kerr & Krause 1950; Ruttner 1956) - Figura 5 e 6. Esse mecanismo reprodutivo possivelmente ajuda a evitar o refluxo de esperma da vagina da rainha ou evita cópulas consecutivas por parte das rainhas (Kerr et al. 1962; Woyciechowski et al. 1994; Melo et al. 2001). O plug dos Meliponini parece mais eficiente em evitar cópulas adicionais porque ele é formado por partes rígidas quitinizadas difíceis de serem removidas por outro macho. Já em Apini, o plug é formado principalmente por regiões moles como as secreções das glândulas de muco e, por isso, são facilmente removidos por outros machos e mesmo pelas rainhas (Koeniger & Koeniger 1991; Colonello & Hartfelder 2005). Os espermatozóides transferidos no momento da cópula migrarão e ficarão armazenados em uma porção do trato reprodutivo denominado espermateca e serão utilizados para fecundarem os ovos que darão origem a operárias e rainhas.
Todo o macho de Apini e Meliponini é obrigatoriamente monogâmico devido ao plug de acasalamento descrito acima, porém, suas parceiras podem não ser. Nas abelhas Meliponini, a rainha virgem geralmente se acasala com um único macho (monandria) e este será o pai de todas as fêmeas produzidas durante o reinado de sua parceira sexual, já nas abelhas melíferas, dezenas de machos têm a oportunidade de se acasalar com uma única rainha durante o voo nupcial dela - algo denominado como poliandria extrema. Desse modo, como fica a paternidade? Os espermatozóides na espermateca da fêmea se misturam ou se agrupam em pacotes? Ao que parece o esperma de alguns machos nos primeiros meses de oviposição são utilizados, formando, portanto, subfamílias temporárias, mas ao longo do tempo, gradualmente, os espermatozóides vão sendo misturados, homogenizados e usados igualmente pelas rainhas fisogástricas (Franck et al. 1999; 2002).
Tendo papel predominantemente reprodutivo, os machos de Apini e Meliponini não se exibem nem defendem territórios, atributos que, somados a outros, caracterizariam seus aglomerados como leques (Alcock 1987). Além disso, a maneira como eles são escolhidos pelas fêmeas reprodutivas é indireta e está mais relacionada a estímulos visuais e olfativos rapidamente percebidos por eles pela presença/ chegada das rainhas virgens e também pela resistência dos machos no aglomerado do que ser um pavão exibicionista. Assim, esses machos, uma vez no aglomerado, têm que se manter o maior tempo possível nele sem o abandonar e com energia suficiente para perseguir a rainha virgem quando de seu voo nupcial (Jaffé & Moritz 2010). Portanto, o estilo bon-vivant desses machos dentro das colônias não retrata a forte pressão seletiva que eles sofrem por ter que superar competidores, predadores, parasitas, escolha feminina indireta e, durante o voo nupcial de poucos segundos com a realeza, literalmente dar a vida para poder gerar outras milhares.
Agradecimentos
Os autores são gratos ao Dr. Cristiano Menezes (Embrapa - Amazônia Oriental) por ter cedido algumas fotografias que ilustram este artigo.
Referências Bibliográficas
Alcock, J. 1987. Leks and hilttopping in insects. Journal of Natural History 21: 319-328.
Alcock, J; Barrows, EM; Gordh, G; Hubbard, LJ; Kirkendall, L; Pyle, DW; Ponder, TL; Zalom, KG. 1978. The ecology and evolution of male reproductive behaviour in the bees and wasps.
Zoological Journal of the Linnean Society 64: 293-326.
Baudry, E; Solignac, M; Garnery, L; Gries, M; Cornuet, JM; Koeniger, N. 1998. Relatedness among honeybees (Apis mellifera) of a drone congregation. Proceedings of the Royal Society B 265: 2009-2014.
Boomsma, JJ; Baer, B; Heinze, J. 2005. The evolution of male traits in social insects. Annual Review of Entomology 50: 395-420.
Brown, BV. 1997. Parasitic phorid flies: a previously unrecognized cost to aggregation behavior of male stingless bees. Biotropica 29: 370-372.
Butler, CG. 1971. The mating behaviour of the honeybee (Apis mellifera L.). Journal of Entomology 46: 1-11.
Cameron, EC; Franck, P; Oldroyd, BP. 2004. Genetic structure of nest aggregations and drone congregations of the southeast Asian stingless bee Trigona collina. Molecular Ecology 13: 2357-2364.
Collet, T; Cristino, AS; Quiroga, CFP; Soares, AEE; Del Lama, MA. 2009. Genetic structure of drone congregation areas of africanized honeybees in southern Brazil. Genetics and Molecular Biology 32: 857-863.
Colonello, NA & Hartfelder, K. 2005. She's my girl - male accessory gland products and their function in the reproductive biology of social bees. Apidologie 36: 231-244.
Cook, JM & Crozier, RH. 1995. Sex determination and population biology in the Hymenoptera. Trends in Ecology and Evolution 10: 281-286.
Cortopassi-Laurino, M. 2009. O refúgio das abelhas "Paulo Nogueira-Neto". Mensagem Doce, 103. Cortopassi-Laurino, M. 2007. Drone congregations in Meliponini: What do they tell us? Bioscience Journal 23: 153-160.
Engels, E & Engels, W. 1984. Drohnen-ansammlungen bei nestern der stachellosen biene Scaptotrigona postica. Apidologie 15: 315-328.
Eickwort, GC & Ginsberg, HS. 1980. Foraging and mating behavior in Apoidea. Annual Review of Entomology 25: 421-446.
Franck, P; Coussy, H; le Conte, Y; Solignac, M; Garnery, L; Cornuet, J-M. 1999. Microsatellite analysis of sperm admixture in honeybee. Insect Molecular Biology 8: 419-421.
Franck, P; Solignac, M; Vautrin, D; Cornuet, J-M; Koeniger, G; Koeniger, N. 2002. Sperm competition and laste-male precedence in the honeybee. Animal Behaviour 64: 503-509.
Galindo-Cardona, A. 2010. Male behavior and hybridization of Africanized and European bees. These in Doctor in Philosophy, University of Puerto Rico, Faculty of Natural Sicences. 133 p.
Imperatriz-Fonseca, VL; Matos, ET; Ferreira, F; Velthuis, HHW. 1998. A case of multiple mating in stingless bees (Meliponinae). Insectes Sociaux 45: 231-233.
Jaffé, R & Moritz, RFA. 2010. Mating flights select for symmetry in honeybee drones (Apis mellifera). Naturwissenschaften 97: 337-343.
Karcher, MH; Biedermann, PHW; Hrassnigg, N; Crailsheim, K. 2008. Predator-prey interaction between drones of Apis mellifera carnica and insectivorous birds. Apidologie 39: 302-309.
Kerr, WE & Krause, W. 1950. Contribuição para o conhecimento da bionomia dos Meliponini. Fecundação da rainha de Melipona quadrifasciata Lep. (Hymenop. - Apoidea). Dusenia 1: 276- 282.
Kerr, WE; Zucchi, R; Nakadaira, JT; Butolo, JE. 1962. Reproduction in the social bees (Hymenoptera: Apidae). Journal of the New York Entomological Society 70: 265-276.
Koedam, D; Slaa, EJ; Biesmeijer, JC; Nogueira-Neto, P. 2009. Unsuccessful attacks dominate a drone preying wasp's hunting performance near stingless bee nests. Genetics Molecular Research 8: 690-702.
Koedam, D; Morgan, ED; Nunes, TM; Patrício, EFLRA; Imperatriz-Fonseca, VL. 2010. Selective preying of the sphecid wasp Trachypusboharti on the meliponine bee Scaptotrigona postica: potential involvement of caste-specific cuticular hydrocarbons. Physiological Entomology, DOI: 10.1111/j.1365-3032.2010.00769.x
Koeniger, N & Koeniger, G. 1991. An evolutionary approach to mating behaviour and drone copulatory organs in Apis. Apidologie 22: 581-590.
Koeniger, N; Koeniger, G; Pechhacker, H. 2005a. The nearer the better? Drones (Apis mellifera) prefer nearer drone congregation areas. Insectes Sociaux 52:31-35
Koeniger, N; Koeniger, G; Gries, M; Tingek, S. 2005b. Drone competition at drone congregation areas in four Apis species. Apidologie 36: 211-221.
Kraus, FB; Weinhold, S; Motirz, RFA. 2008. Genetic structure of drone congregations of the stingless bee Scaptotrigona mexicana. Insectes Sociaux 55 : 22-27.
López, JCG & Kraus, FB. 2009. Cherchez la femme? Site choice of drone congregations in the stingless bee Scaptotrigona mexicana. Animal Behaviour 77: 1247-1252.
Mazeed, AM & Mohanny, KM. 2010. Some reproductive characteristics of honeybee drones in relation to their ages. Entomological Research 40: 245-250.
Melo, GAR; Buschini, ML; Campos, LAO. 2001. Ovarian activation in Melipona quadrifasciata queens triggered by mating plug stimulation (Hymenoptera, Apidae). Apidologie 32: 355-361.
Michener, CD. 1974. The social behavior of the bees: a comparative study. Harvard University Press. 404p.
Nogueira-Neto, P. 1954. Notas bionômicas sobre meliponíneos III - sobre a enxameagem. Arquivos do Museu Nacional 19: 419-452
Nogueira-Neto, P. 1997. Vida e criação de abelhas indígenas sem ferrão. Nogueirapis, São Paulo, 445p.
Paxton, RJ. 2000. Genetic structure of colonies and a male aggregation in the stingless bee Scaptotrigona postica, as revealed by microsatellite analysis. Insectes Sociaux 47: 63-69.
Paxton, RJ; Bego, LR; Shah, MM; Mateus, S. 2003. Low mating frequency of queens in the stingless bee Scaptotrigona postica and maternity of males. Behavioral Ecology and Sociobiology 53: 174-181.
Paxton, RJ. 2005. Male mating behaviour and systems of bees: an review. Apidologie 36: 145-156.
Ribi, WA; Engels, E; Engels, W. 1989. Sex and caste specific eye structures in stingless bees and honey bees (Hymenoptera: Trigonidae, Apidae). Entomologia Generalis 14: 233-242.
Roubik, DW. 1990. Mate location and mate competition in males if stingless bees (Hymenoptera: Apidae: Meliponanae). Entomologia Generalis 15: 115:120.
Ruttner, F. 1956. The mating of the honeybee. Bee World 37: 2-15, 23-24.
Ruttner, F. 1966. The life and flight activity of drones. Bee World 47: 93-100.
Snodgrass, RE. 1910. The anatomy of the honey bee. Cornell University Library. 236 p.
Sommeijer, MJ & Bruijn, LLM. 1995. Drone congregations apart from the nest in Melipona favosa. Insectes Sociaux 42: 123-127.
Sommeijer, MJ; Bruijn, LLM; Meeuwsen, FJAJ. 2003. Behaviour of males, gynes and workers at drone congregation sites of the stingless bee Melipona favosa (Apidae: Meliponini). Entomologische Berichten 64: 10-15.
Veen, JW van & Sommeijer, MJ. 2000. Observations on gynes and drones around nuptial flights in the stinglees bees Tetragonisca angustula and Melipona beecheii (Hymenoptera, Apidae). Apidologie 31: 47-54.
Velthuis, HHW; Koedam, D; Imperatriz-Fonseca, VL. 2005. The male of Melipona and other stingless bees, and their mothers. Apidologie 36: 169-185.
Woyciechowski, M; Kabat, L; Krol, E. 1994. The function of the mating sign in honey bees Apis mellifera L - new evidence. Animal Behaviour 47: 733-735.