Artigo
Importância da disponibilidade de locais para nidificação de abelhas na polinização agrícola: o caso das mamangavas de toco.
Breno Magalhães Freitas1 & José Everton Alves2,31 Professor da Universidade Federal do Ceará, Departamento de Zootecnia - CCA. C.P. 12168 Fortaleza-CE 60.021-970.
2 Professor da Universidade Estadual Vale do Acaraú, Curso de Zootecnia. Av. da Universidade, 850. Sobral-CE 62.040-370.
3 Doutorando em Zootecnia na Universidade Federal do Ceará.
Introdução
Polinização é o nome dado à transferência dos grãos de pólen da antera (estrutura masculina das flores) para o estigma (estrutura feminina das flores). Esse processo é essencial para a fecundação dos óvulos das flores, dando origem às sementes e frutos que asseguram a perpetuação da maioria das espécies vegetais do planeta e a produtividade das culturas cujos produtos são vagens, nozes, castanhas, frutas, grãos ou sementes (Freitas 1995). Como as plantas não andam, elas precisam de agentes que possam transferir os grãos de pólen entre as flores. Esses agentes são o vento, a água, a gravidade e, principalmente, os animais. Cerca de 75% das culturas e 80% das espécies de plantas dotadas de flores dependem da polinização feita por animais como morcegos, pássaros, borboletas, mariposas, vespas, besouros, moscas e, principalmente, as abelhas (Kevan & Imperatriz-Fonseca 2002, Ricketts et al. 2008). Estima-se que aproximadamente 73% das espécies agrícolas cultivadas no mundo seja polinizada por espécies de abelhas (FAO 2004).
Para se ter uma compreensão da importância dos serviços prestados pelos polinizadores, se considerando as culturas dependentes desses agentes, a contribuição para a agricultura mundial excederia os US$ 54 bilhões (Constanza et al. 1997, Dias et al. 1999). No Brasil, apenas oito culturas dependentes de polinizadores são responsáveis por US$ 9,3 bilhões em exportações (Freitas & Imperatriz-Fonseca 2004, 2005). No entanto, a população de muitos polinizadores está diminuindo a níveis que comprometem os serviços de polinização nos ecossistemas naturais e agrícolas e a manutenção da capacidade reprodutiva de plantas silvestres (Kremen 2004). O declínio dos polinizadores, especialmente as abelhas, em áreas agrícolas normalmente é atribuído ao uso de defensivos agrícolas, que matariam ou afastariam os polinizadores das culturas, e aos desmatamentos que eliminariam as fontes de alimento (pólen, néctar, óleos vegetais), locais de abrigo do clima e predadores e para nidificação e reprodução (Kremen et al. 2002, Larsen et al. 2005). Dentre esses, tem se dado maior ênfase aos problemas causados pelos defensivos agrícolas e redução das fontes de alimento, esquecendo-se da importância dos locais para nidificação e reprodução, sem os quais os polinizadores não podem se perpetuar na área (Freitas & Pereira, 2004; Malaspina et al. 2008).
No presente trabalho, procurou-se discutir a relevância da disponibilidade de locais para nidificação de abelhas na polinização agrícola de uma forma geral. No entanto, para detalhar e facilitar a compreensão foram usadas como exemplo as abelhas do gênero Xylocopa (mamangavas de toco) cuja presença nas áreas cultivadas depende da existência de substrato apropriado para reproduzirem.
Locais e recursos utilizados por abelhas para nidificação
As abelhas podem nidificar em uma variedade de substratos que vão do solo a ocos em troncos de madeira, passando por cupinzeiros e formigueiros abandonados, talos de gramíneas, até conchas de caramujos, dependendo da espécie, do seu hábito reprodutivo e habitat onde ocorre (O'Toole & Raw 1991). De forma semelhante, as abelhas também fazem uso de uma diversidade de materiais ou combinações destes para a construção de seus ninhos. Portanto, folhas de plantas, resinas, barro, areia, óleos vegetais, celulose, madeira mastigada, além de secreções salivares e cera produzida por elas próprias são essenciais para a reprodução de muitas espécies abelhas. A existência desses recursos na área pode determinar a presença ou não de uma certa espécie de abelha na área.
A distância dos ninhos para as plantas cultivadas pode impedir a visitação às flores. Rizzardo (2006), em Fortaleza, observou que abelhas do gênero Scaptotrigona e Apis mellifera visitavam flores de mamoneira (Ricinus communis) em um pequeno plantio próximo aos seus ninhos, mas em um grande plantio comercial de 3.600 ha em Canto do Buriti, estado do Piauí, Apis mellifera era a única abelha social que frequentava as flores da cultura, provavelmente devido a grande distância de matas, onde ocorrem árvores com ocos necessários à nidificação de Scaptotrigona e a maioria das abelhas nativas sem ferrão.
O local de nidificação é fundamental para o estabelecimento de polinizadores, principalmente abelhas solitárias, depende muito da existência de locais propícios para sua reprodução. A abelha solitária Nomia melanderi poliniza as flores de alfafa (Medicago sativa) e constrói seus ninhos escavando o solo. No entanto, ela é muito exigente quanto ao tipo e condições de solo, nidificando apenas em solos leves, ligeiramente úmidos, sem camada superficial de sal e em locais descobertos ou com vegetação bem esparsa. Nos EUA, produtores de alfafa procuram preservar locais de nidificação naturais próximo aos seus cultivos, estabelecer plantios nas vizinhanças de agregações de ninhos naturais, deixar áreas limpas no entorno das áreas cultivadas para incentivar a nidificação espontânea, ou mesmo criar locais artificiais de nidificação escavando grandes segmentos de solo inadequados para a nidificação da abelha e substituindo-os por materiais favoráveis à nidificação de N. melanderi (O'Toole & Raw 1991, Free 1993).
A falta do material propício para construção do ninho também pode evitar a o estabelecimento de populações adequadas do polinizador. A abelha solitária Centris tarsata foi apontada por Freitas & Paxton (1998) como um polinizador nativo do cajueiro (Anacardium occidentale) em estado silvestre no litoral cearense. No entanto, essa e outras espécies de Centris não foram encontradas nas grandes áreas cultivadas, onde havia uma oferta de pólen e néctar muito maior do que nas dunas da região costeira. No entanto, segundo Freitas & Pereira (2004), os grandes pomares de cajueiro eliminaram espécies nativas de plantas com flores produtoras de óleos, como o murici (Byrsonimia crassifolia), que fornecem os óleos essenciais para as abelhas Centris construírem seus ninhos e alimentarem suas crias. Dessa forma, essas abelhas não conseguem estabelecer populações nas áreas de cajueiro cultivado, embora o façam nas dunas litorâneas, ainda ricas em muricizeiros.
As abelhas solitárias Megachile rotundata, polinizadora de alfafa, e várias espécies do gênero Osmia, como O. rufa, O. lignaria e O. conrnifrons, polinizadoras de plantas da família Rosaceae, como a macieira (Malus domestica), também são muito específicas quanto ao material para construção de seus ninhos. Ambas necessitam de cavidades pré-existentes dentro da área cultivada para nidificarem, mas enquanto M. rotundata corta e usa as folhas da própria alfafa para revestir a cavidade e construir as células onde cada larva se desenvolverá, as Osmia spp. usam barro úmido que recolhem nas proximidades dos ninhos (O'Toole & Raw 1991, Free 1993). Portanto, a presença de locais adequados e de materiais de construção dentro da área cultivada são essenciais para a presença desses polinizadores em números adequados para uma polinização eficiente.
A ausência do substrato adequado de nidificação pode diminuir consideravelmente a presença do polinizador na área de cultivo comprometendo os níveis de polinização idéias da cultura. Dois estudos sobre a polinização do maracujá amarelo (Passiflora edulis cf. flavicarpa) conduzidos em São Luis do Curú, Ceará (Freitas & Oliveira-Filho 2001) e Holambra, São Paulo (Camillo 1996) apontaram aumentos de 92 e 700% respectivamente, após a introdução nos plantios de 25 ninhos/ha da mamangava de toco Xylocopa frontalis. Comparações feitas por Freitas e Oliveira-Filho (2003) entre esses dois estudos sugerem que essa diferença em produtividade se deveu ao fato do número de X. frontalis silvestre na área dos experimentos antes da introdução dos ninhos ser muito menor no pomar do Sudeste do que no do Nordeste. Isso ocorria porque a paisagem eminentemente agrícola de Holambra não apresentava o substrato adequado para a nidificação natural de mamangavas de toco nas proximidades do plantio. Por outro lado, o cultivo de São Luis do Curú possuía matas nas vizinhanças onde as mamangavas encontravam madeira morta para escavar seus ninhos, fornecendo, portanto, mais abelhas para a polinização das flores nas redondezas.
As abelhas mamangavas de toco
As abelhas popularmente chamadas de mamangavas de toco ou simplesmente mamangavas pertencem ao gênero Xylocopa e existem 750 espécies descritas em todo o mundo, agrupadas em 48 subgêneros (Michener 1979, Hogerdoon 1994). No Brasil existem catalogadas cinqüenta e duas espécies de mamangavas distribuídas em 13 subgêneros (Hurd 1978). Apesar de não formarem colônias, a maioria das espécies de mamangavas de toco apresenta longevidade prolongada das fêmeas, sobreposição de gerações e tolerância à presença de membros da mesma espécie no ninho. Estas características são típicas de espécies que estão evoluindo para a eusocialidade, ou seja, para tornarem-se sociais (Michener, 1974).
As mamangavas de toco são abelhas essenciais para a polinização de várias espécies de plantas nativas da caatinga, mata atlântica, cerrado, mata amazônica ou de zonas litorâneas. Elas também são polinizadoras efetivas de várias culturas importantes, marcadamente aquelas de flores grandes, nas quais abelhas de menor porte tem dificuldades de tocar as partes reprodutivas e atuar como polinizadores efetivos, como várias espécies de maracujá (Passiflora spp.), castanha do Brasil (Bertholletia excelsa), abóbora (Curcubita moschata), canavália (Canavalia ensiformis), urucum (Bixa orellana), feijão caupi (Vigna unguiculata), goiaba (Psidium guajava), e tomate (Lycopersicum esculentum) (Figura 1).
No entanto, a contribuição dessas abelhas na polinização agrícola brasileira tem sido pequena devido aos seus escassos números nos plantios, levando a quebras de produtividade das culturas que dependem da polinização por essas abelhas ou obrigando os produtores a recorrerem a polinização manual para assegurarem os índices de polinização adequados em suas plantações, como é bastante conhecido no cultivo do maracujá. Vários tem determinado essa ausência de mamangavas nas áreas agrícolas, como o pequeno número de indivíduos produzidos por ninho; o uso inadequado de defensivos agrícolas; a falta de fontes alternativas de alimento na área quando a cultura não está em florescimento; e, principalmente, a ausência de locais para nidificação próximo dos plantios, haja vista que a grande maioria dessas abelhas só constrói seus ninhos em tecido vegetal lenhoso, de preferência morto. Além disso, as mamangavas apresentam uma série características peculiares de nidificação determinantes para o seu estabelecimento ou persistência em uma área (Freitas & Oliveira-Filho 2001).
Hábitos de nidificação do gênero Xylocopa
Os critérios utilizados pelas fêmeas de abelhas solitárias, como as mamangavas de toco, na escolha dos locais ideais para a nidificação não foram ainda bem elucidados. Há indícios de que a distribuição dos ninhos se dá, freqüentemente, formando agrupamentos. No Brasil, existe documentação de agregações de ninhos de Xylocopa ordinaria no Rio de Janeiro (Bernardino e Gaglianone 2008) e de Xylocopa cearensis na Bahia (Viana et al., 2002). Possivelmente o surgimento de novos ninhos ocorre próximo a ninhos ativos preexistentes (podendo ser o ninho parental), ou por atrativos químicos (feromônios de agregação) (Roubik 1989, Sihag 1993). O local escolhido é baseado ainda pela presença de recursos florais e pela disponibilidade de substrato para nidificação (Sihag 1993).
Os locais onde comumente são confeccionados os ninhos de mamangavas são em substratos vivos, mas mais comumente em estruturas de madeira morta, preferencialmente seca ou já iniciando o processo de decomposição, mas que não apresente rachaduras que permitam a infiltração de água (Hurd & Moure 1963). São encontrados ninhos em mourões de cerca, estacas, postes de madeira além de madeiras usadas em construções humanas (Freitas e Oliveira Filho 2001, Hogendoorn 1994, Sakagami & Laroca 1971). No entanto, diferentemente da grande maioria das espécies de abelhas que nidificam em árvores vivas ou mortas, essas abelhas não ocupam cavidades pré-existentes na madeira, precisando escavar seus próprios ninhos. Essa característica marcante deste grupo de abelhas é fator decisivo para o estabelecimento de ninhos e também para a dificuldade de criar essas abelhas visando serviços de polinização (Oliveira-Filho & Freitas 2003).
A escolha do local para o futuro ninho e sua construção foi descrita por Freitas & Oliveira-Filho (2001) conforme apresentado a seguir. Após a fêmea localizar sítios potenciais para seu ninho, baseada na distância à fonte de alimento, preferência por substrato e outros fatores já discutidos anteriormente, ela passa a fazer inspeções com vôos circulares e pousos sucessivos acompanhados de caminhadas na madeira em busca de um local adequado. Uma vez escolhido o lugar, o passo seguinte é realizar, sempre na parte lateral ou inferior do substrato, uma pré-escavação para inspecionar de forma mais detalhada e poder observar com mais clareza o substrato a ser escavado (Figura 2). Caso esteja satisfeita, a fêmea continuará a escavação da madeira. Neste momento, as mamangavas apresentam-se muito sensíveis a perturbações, podendo abandonar o ninho recém-iniciado caso não tenham paz para trabalhar, pois isso indicaria um local inadequado para criar sua prole.
Inicialmente a mamangava confecciona uma galeria que, dependendo da disposição da madeira e do lenho desta, geralmente segue uma orientação vertical e ascendente com relação à entrada de seu ninho. Esta primeira galeria não penetra muito na madeira e normalmente a fêmea constrói uma a três células que abastece, cada uma delas, com uma mistura de pólen e néctar, moldando-a em formato ovóide, sobre a qual deposita um único ovo. Estas células são construídas de forma seqüencial onde a primeira postura é sempre mais ao fundo da galeria, sendo as demais postas sucessivamente até preencher todas as células da galeria. O tamanho (diâmetro e comprimento) da célula é uma característica de cada espécie de mamangava e do número de gerações que utilizaram o ninho (Figura 3).
Garantidas as primeiras posturas, a fêmea trata então de construir o restante do ninho escavando outras galerias mais profundas partindo do mesmo local de início da primeira e seguindo com o mesmo padrão descrito anteriormente. Para isso, a fêmea escava uma câmara bastante larga logo no início do ninho que possibilita a construção de galerias em outras direções. As próximas galerias serão mais profundas e, para cada novo ciclo de postura são escavadas novas galerias. O ninho pode ser reutilizado pela fêmea-mãe ou por suas filhas por várias gerações, dependendo somente dos limites impostos pelo substrato.
Requerimentos importantes para nidificação de Xylocopa
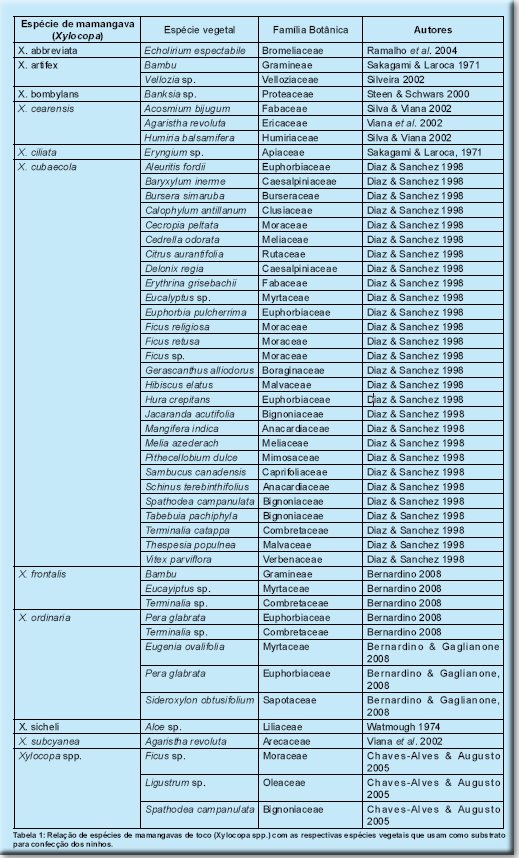
Em geral, as espécies do gênero Xylocopa não apresentam especialização quanto ao tipo de substrato usado para nidificação, mas madeiras de lenho muito denso e duro normalmente são desconsideradas (Camillo & Garófalo 1982, Camillo et al. 1986). Entretanto, alguns trabalhos apontam espécies vegetais onde seria mais comum encontrar ninhos de determinadas espécies de mamangavas de toco (Sakagami & Laroca 1971, Ramalho et al., 2004). Esses estudos sugerem poder haver algum tipo de preferência por características da madeira (dureza, disposição das fibras, durabilidade, etc.), pelo menos por algumas espécies de Xylocopa. Xylocopa bombylans, por exemplo, teria preferência por nidificar em Banksia sp., enquanto Xylocopa abbreviata nidifica com maior freqüência em Echolirium espectabile (Ramalho et al. 2004). Esse comportamento ocorreria ainda em Xylocopa ciliata, com preferência de nidificação em Eryngium sp. (Sakagami & Laroca 1971) e com Xylocopa artifex que nidifica em bambus (Sakagami & Laroca, 1971) (Tabela 1). Há a necessidade de maiores estudos sobre o assunto, uma vez que a identificação e disponibilização dentro ou nas proximidades dos cultivos de substratos requeridos pelos polinizadores para nidificação é essencial para atraí-los para as flores das culturas.
A altura de nidificação é muito variável, pois depende da espécie e da disponibilidade de madeira com características favoráveis à sua construção. Normalmente são encontrados ninhos em galhos de árvores a vários metros de altura do solo, porém já foram encontrados ninhos até em galhos caídos sobre o solo (Viana et al, 2002). Aparentemente, as mamangavas de toco preferem nidificar em galhos altos, mas na indisponibilidade destes locais aceitariam outros mais baixos, desde que o substrato possua as condições adequadas para a construção do ninho (Freitas & Oliveira-Filho 2001). É preciso averiguar se isso acontece com todas as espécies ou se a altura do ninho seria fator limitante para alguma(s) dela(s).
O diâmetro da madeira também é um requerimento importante do substrato a ser considerado. As galerias do ninho devem possuir, no mínimo, o mesmo do corpo dos indivíduos adultos para permitir seu deslocamento dentro destas. Entretanto, em alguns locais a galeria é construída com diâmetro mais amplo para permitir que a fêmea-mãe possa curvar-se e dar a volta sobre si mesma, com a finalidade de sair de frente do ninho; para facilitar a escavação de novas galerias; ou para o preparo de novas células que receberão as próximas crias. Isto significa que a planta para nidificação deve não só possuir as características requeridas por cada espécie de mamangava de toco como também o diâmetro necessário para acomodar a arquitetura dos ninhos.
Um fator relevante a considerar é que as espécies vegetais usadas pelas mamangavas de toco para nidificação comumente não são exploradas por elas como fontes de alimento. Dentre as 49 espécies vegetais descritas na literatura como locais de nidificação de várias espécies de Xylocopa (Tabela 1), apenas seis foram visitadas por essas abelhas em busca de pólen e/ou néctar: Sambucus canadensis, Tabebuia pachiphyla, Melia azederach, Vitex parviflora, Eugenia ovalifolia e Sideroxylon obtusifolium.
Considerações finais
As abelhas de uma maneira geral, e as mamangavas de toco de forma particular, são importantes polinizadores agrícolas. Suas ausências na maioria das áreas cultivadas implicam em quedas de produtividade e, em muitos casos, na necessidade de contratação de mão de obra para polinização manual das flores. Ambas as situações levam a perda de rentabilidade da cultura, seja pela menor produção obtida por valor investido ou pelo aumento dos custos de produção com o uso de 'polinizadores' humanos. Consequentemente, essa situação não tem produzido resultados agrícolas satisfatórios, sendo cada vez mais marcantes os alertas sobre as conseqüências da perda de polinizadores na agricultura mundial (Buchmann & Nabhan 1996, Dias et al. 1999, FAO 2004, Kremen et al. 2002, Larsen et al. 2005).
Vários motivos, isolados ou em associação, tem sido implicados como responsáveis pela redução no número de polinizadores nos cultivos, como a perda de diversidade de plantas e animais na área (polinizadores complementares, fonte de alimento para períodos sem florescimento da cultura, fontes alternativas de pólen e néctar, etc.); tratos culturais (irrigação, florescimento induzido em ciclo curto, uso de herbicidas, fungicidas, acaricidas e inseticidas, etc.); destruição de ninhos (remoção de plantas vivas ou mortas com ocos ou cavidades usadas como ninhos, revolvimento ou compactação do solo, etc.), entre outros. No entanto, todos esses fatores são problemas criados dentro do cultivo, dando a impressão de que a falta de polinizadores nos plantios está restrita exclusivamente a situações existentes dentro do limite da área agrícola e que os níveis adequados de polinização seriam restabelecidos ao se amenizar esses problemas. Na verdade, a decisão de adotar sistemas de produção dentro dos cultivos que sejam mais 'amigáveis' para os polinizadores é desejável e importante. Porém, muitos serviços dos ecossistemas, como a polinização, dependem de habitats espacialmente ou temporariamente separados do local onde o serviço é realizado (Kremen et al. 2007).
Considerando que os problemas com as demais práticas agrícolas sejam solucionados, as mamangavas de toco exemplificam bem a necessidade de conservação dos locais de nidificação e da importância dos ecossistemas ao redor dos plantios. Embora o cultivo de maracujá, por exemplo, não permita o consórcio da cultura com matas na mesma área como é feito com o café sombreado, algumas práticas podem ser adotadas para oferecer locais de nidificação: o uso de mourões de madeira adequada na confecção das espaldeiras; a prática de deixar os tocos de árvores ou introduzi-los na área durante o cultivo; ou mesmo providenciar estruturas artificiais como pedaços de bambu e ninhos racionais, conforme proposto por Camillo (1996) e Freitas & Oliveira-Filho (2001) (Figura 4). Esses procedimentos podem estimular a nidificação dentro da área de cultivo e aumentar o número de polinizadores nas flores. No entanto, nada disso funcionará se os pomares de maracujá não possuírem nas redondezas matas saudáveis com populações estáveis de mamangavas de toco que possam fazer uso de suas flores na alimentação e produção de novas gerações de mamangavas de toco. São essas novas abelhas que, em busca de locais para nidificar, poderão colonizar as estruturas deixadas ou colocadas dentro do pomar, atraídas pela proximidade da fonte de alimento. Essas matas, além de fornecedora de polinizadores para o plantio de forma direta (as mamangavas que nidificam lá e visitam as flores do cultivo) e indireta (as novas mamangavas que colonizam os ninhos dentro da área agrícola), também poderão sustentar as abelhas com alimento quando os maracujazeiros não estiverem florescendo, fixando as populações nas proximidades do pomar e mantendo-as com números suficientes de abelhas para polinizarem efetivamente a cultura no próximo ciclo de florescimento (Figura 5). Portanto, a conservação dos habitats nativos da região de cultivo, ou sua recuperação, é fundamental para o suprimento adequado de polinizadores nas culturas dependentes das mamangavas de toco para polinização.
 Figura 1 - Xylocopa frontalis macho polinizando flor de maracujá amarelo (Passiflora edulis). |
 Figura 2 - Fêmea de mamangava do toco em busca de local para nidificação, inspecionando um tronco de madeira. |
 Figura 3 - Fêmea adulta de Xylocopa frontalis e larvas no ninho. O Ninho é escavado na madeira em forma de galerias divididas em células individuais. |
Figura 4: Tronco de madeira e ninho racional que podem ser colocados nos cultivos como locais para nidificação de mamangavas de toco (Xylocopa spp.). Fonte: Freitas e Oliveira Filho 2001 |
 Figura 4 |
 Figura 5 - Matas nativas nas proximidades dos cultivos fornecem alimento para os polinizadores quando a cultura não está florescendo. Aqui uma mamangava de toco (Xylocopa sp.) coleta néctar em Capparis flexuosa. |
 |
Referências Bibliográficas
BERNARDINO, A. S. 2008. Biologia de nidificação e estratégias de manejo de Xylocopa ordinaria e Xylocopa frontalis (Hymenoptera: Apidae) no norte do Rio de Janeiro. Dissertação (Mestrado em Ecologia e Recursos Naturais) - Universidade Estadual do Norte Fluminense Darcy Ribeiro.
BERNARDINO, A. S. & GAGLIANONE, M. C. 2008. Nest distribution and nesting habits of Xylocopa ordinaria Smith (Hymenoptera, Apidae) in a restinga area in the northern Rio de Janeiro State, Brazil. Revista Brasileira de Entomologia, 52 : 434-440.
BUCHMANN, S. & NABHAN, G. 1996. The forgotten pollinators. Island Press, Washington D.C. 292p.
CAMILLO, E. 1996. Utilização de espécies de Xylocopa (Hymenoptera:Anthophoridae) na polinização do maracujá amarelo. Pp: 141-146. In: Anais do II Encontro Sobre Abelhas. Ribeirão Preto, SP. 351p.
CAMILLO, E. & GARÓFALO, C. A. 1982. On the bionomics of Xylocopa frontalis (Oliver) in southern Brazil: I - Nest construction and biological cycle. Revista Brasileira de Biologia, 42:571-582.
CAMILLO, E; GARÓFALO, C. A. & MUCCILLO, G. 1986. On the bionomics of Xylocopa suspecta (Moure) in southern Brazil: nest construction and biological cycle (Hymenoptera: Anthophoridae). Revista Brasileira de Biologia, 46:383-393.
CHAVES-ALVES, T. M. & AUGUSTO, S. C. 2005. Recursos ecológicos por Xylocopa spp. em área urbana, Uberlândia-MG, Brasil. In: Anais do VII Congresso de Ecologia do Brasil, Caxambu. 2005.
COSTANZA, R.; D'ARGE, R.; DE GROOT, R.; FARBER, S; GRASSO, M.; HANNON, B.; LIMBURG, K.; NAEEM, S.; O'NEIL, R. V.; PARUELO, J.; RASLIN, R. G.; SUTTON, P. & VAN DEN BELT, M. 1997. The value of the world's ecosystem services and natural capital. Nature, 387: 253-260.
DIAS, B. S. F.; RAW, A. & IMPERATRIZ-FONSECA, V. L. 1999. International Pollinators Initiative: The São Paulo Declaration on Pollinators. Report on the recommendations of the Workshop on the Conservation and Sustainable Use of Pollinators in Agriculture with Emphasis on Bees. Ministry of Environment (MMA), University of Sao Paulo (USP) and Brazilian Corporation for Agricultural Research (Embrapa), Brasília. 79p.
DIAZ, A. L. & SÁNCHEZ, U. S. 1998. Feeding and nesting plants of Xylocopa cubaedola. Caribean Journal of Science, 34: 152-155.
FAO (FOOD AND AGRICULTURE ORGANIZATION). 2004. Conservation and management of pollinators for sustainable agriculture - the international response. Pp. 19-25. In: B. M. FREITAS & J.O.B. PORTELA (Eds.). Solitary bees: conservation, rearing and management for pollination. Imprensa Universitária UFC, Fortaleza. 285p.
FREE, J. B. 1993. Insect pollination of crops. University Printing House, Cambridge, UK. 684p.
FREITAS, B. M. 1995. The pollination efficience of foraging bees on apple (Malus domestica Borkh) and cashew (Anacardium occidentale L.). Tese de PhD. University of Wales, U.K. 197p.
FREITAS, B. M, OLIVEIRA FILHO, J. H. 2001. Criação racional de mamangavas para polinização em áreas agrícolas. Banco do Nordeste, Fortaleza. 96p.
FREITAS, B.M. & OLIVEIRA-FILHO, J.H. 2003. Ninhos racionais para mamangava (Xylocopa frontalis) na polinização do maracuá-amarelo (Passiflora edulis). Ciência Rural, 33: 1135-1139.
FREITAS, B. M. & IMPERATRIZ-FONSECA, V. L. 2004. Economic value of Brazilian cash crops and estimates of their pollination constrains. Pp. 1-4. In: Food and Agriculture Organization (FAO) report 02, Agreement Food and Agriculture Organization (FAO)- Fundação da Universidade de São Paulo (FUSP). Economic value of pollination and pollinators. São Paulo, SP, Brazil. 64p.
FREITAS, B. M. & PEREIRA, J. O. P. 2004. Crop consortium to improve pollination: can West Indian Cherry (Malpighia emarginata) attract Centris bees to pollinate Cashew (Anacardium occidentale)? Pp: 193-201. In: B. M. FREITAS & J.O.B. PORTELA (Eds.). Solitary bees: conservation, rearing and management for pollination. Imprensa Universitária UFC, Fortaleza. 285p.
FREITAS, B. M. & IMPERATRIZ-FONSECA, V. L. 2005. A importância econômica da polinização. Mensagem Doce, 80: 44-46.
HOGENDOORN, K. 1994. Socio-economics of the Carpenter bee Xylocopa pubescens. Tese de Doutorado. Universidade de Utrecht, Holanda. 144 p.
HURD, P. D. 1978. An annoted catalog of the carpenter bees (genus Xylocopa Latreille) of the western hemisphere (Hymenoptera, Anthophoridae). Smithsonian Institution Press, Washington D.C. 106p.
HURD, P. D. & MOURE, J. S. 1963. A classification of the large carpenter bee (Xylocopini). Univ. Calif. Publs. Ent., 29:1-365.
KEVAN, P. G. & IMPERATRIZ-FONSECA, V. L. 2002 Pollinating bees: the conservation link between agriculture and nature. Ministry of Environment, Brasília. 313p.
KREMEN, C. 2004. Pollination services and community composition: does it depend on diversity, abundance, biomass or species traits? P: 115-124. In: B. M. FREITAS & J.O.B. PORTELA (Eds.). Solitary bees: conservation, rearing and management for pollination. Imprensa Universitária UFC, Fortaleza. 285p.
KREMEN, C.; WILLIAMS, N .M. & THORP, R. W. 2002. Crop pollination from native bees at risk from agricultural intensification. Proceedings of the National Academy of Science of the U.S.A., 99: 16812-16816.
KREMEN, C.; WILLIAMS, N. M.; AIZEN, M. A.; GEMMILL-HERREN, B.; LEBUHN, G.; MINCKLEY, R.; PACKER, L.; POTTS, S.; ROULSTON, T.; STEFFAN-DEWENTER, I.; VÁSQUEZ, D. P.; WINFREE, R.; ADAMS, L.; CRONE, E. E.; GREENLEAF, S. S.; KEITT, T. H.; KLEIN, A. M.; REGETZ, J. & RICKETTS, T. H. 2007. Pollination and other ecosystem services produced by mobile organisms: a conceptual framework for the effects of land-use change. Ecology Letters, 10: 299-314.
LARSEN, T. H.; WILLIAMS, N. W. & KREMEN, C. 2005. Extinction order and altered community structure rapidly disrupt ecosystem functioning. Ecology Letters, 8: 538-547.
MALASPINA, O.; SOUZA, T. F.; ZACARIN, E. C. M. S.; CRUZ, A. S. & JESUS, D. 2008. Efeitos provocados por agrotóxicos em abelhas no Brasil. Pp. 41-48. In: Anais do VIII Encontro sobre Abelhas. Ribeirão Preto, SP. 763p.
MICHENER, C. D. 1979. Biogeography of the bees. Annals of the Missouri Botanical Garden, 66: 277-347.
OLIVEIRA FILHO, J. H. & FREITAS, B. M. 2003. Colonização e biologia reprodutiva de mamangavas (Xylocopa frontalis) em um modelo de ninho racional. Ciência Rural, 33: 693-697. .
O'TOOLE, C. & RAW, A. 1991. Bees of the World. Blanford, London. 192p.
RICKETTS, T.H; REGETZ, J.; STEFFAN-DEWENTER, I.; CUNNINGHAM, S.A; KREMEN, C.; BOGDANSKI, A.; GEMMILL-HERREN, B.; GREENLEAF, S.S; KLEIN, A.M; MAYFIELD, M.M; MORANDIN, L.A; OCHIENG, A & VIANA, B.F. 2008. Landscape effects on crop pollination services: are there general patterns? Ecology Letters, 11: 499-515.
RAMALHO, M; BATISTA M. A. & SILVA, M. 2004. Xylocopa (Monoxylocopa) abbreviata Hurd & Moure (Hymenoptera:Apidae) e Encholirium spectabile (Bromeliaceae): Uma Associação estreita no Semi-Árido do Brasil. Tropical. Neotropical Entomology, 33: 417-425.
RIZZARDO, R. A. G. 2007. O papel de Apis mellifera L. como polinizador da mamoneira (Ricinus communis L.): avaliação da eficiência de polinização das abelhas e incremento da produtividade da cultura. Dissertação (Mestrado em Zootecnia). Universidade Federal do Ceará, Fortaleza.
ROUBIK, D. W. 1989. Ecology and Natural History of Tropical Bees. Cambridge University Press, New York. 514p.
SAKAGAMI, S. F. & S. LAROCA. 1971. Observations on the bionomics of some neotropical Xylocopini bees, with comparative biofaunistic notes (Hymenoptera, Anthophoridae). Journal of the Faculty of Science of the Hokkaido University, 6 (Zool., Sapporo) 18: 57-127.
SILVEIRA, F. A. 2002. The bamboo-nesting carpenter bee, Xylocopa (Stenoxylocopa) artifex Smith (Hymenoptera: Apidae), also nesting fibrous branches of Vellozia (Velloziaceae). Lundiana, 3:57-60.
STEEN, Z. & SCHWARS, M. P. 2000. Nesting and life cycle of the Australian green carpenter bees Xylocopa (Lestis) aeratus Smith and Xylocopa (Lestis) bombylans (Fabricius) (Hymenoptera: Apidae: Xylocopinae). Australian Journal of Entomology, 39: 291-300.
VIANA, B. F.; KLEINERT, A. M. P. & SILVA, F. O. 2002. Ecologia de Xylocopa (Neoxylocopa) cearensis (hymenoptera, Anthophoridae) nas dunas litorâneas de Abaeté, Salvador, Bahia. Iheringia, 92: 47-57.
WATMOUGH, R. H. 1974. Biology and behaviour of carpenter bees in southern Africa. Journal of Entomology Society of South Africa, 37: 261-281.